现有A、B、C、D、E五种原子序数依次增大的短周期元素,其中在所有的短周期元素中,A的原子半径与D的原子半径之比最小(不包括稀有气体),C与A、B、D均能形成多种常见化合物,B元素的最高价氧化物对应的水化物与其氢化物反应生成一种盐,化合物AE常温下为气体。回答下列问题:
(1)A分别与B、C形成的最简单化合物中,稳定性 > (用分子式表示),其中A与B形成的最简单化合物分子的空间构型为 ;
(2)化合物甲、乙均是由上述五种元素中的三种组成的强电解质,且常温下两种物质的水溶液pH均大于7,组成元素的原子数目比均为1∶1∶1,其中乙是某种家用消毒液的有效成分,则化合物甲的电子式为 。
(3)化合物丙由C和D两种元素组成,其中C和D的原子个数比为1∶1,则丙中含有的化学键类型是 ;
(4)B元素的最高价氧化物对应的水化物与其氢化物反应生成的盐的水溶液呈 性(填“酸”、“碱”或“中”),用离子方程式解释原因 ;
(5)写出实验室制取单质E的离子方程式是 。
有X、Y、Z三种元素:
①X、Y、Z的单质在常温下均为气体;
②X单质可以在Z的单质中燃烧,生成物为XZ,火焰呈苍白色;
③XZ极易溶于水,在水溶液中电离出X+和Z—,其水溶液能使蓝色石蕊试纸变红;
④每2个X2分子能与1个Y2分子化合成2个X2Y分子,X2Y常温下为液体;
⑤Z单质溶于X2Y中,所得溶液具有漂白性。
完成下列填空:
⑴试写出其元素符号:X_______,Y_______, Z_______,以及化合物的分子式:XZ_______,X2Y_________。
⑵写出Z单质与X2Y反应的化学方程式:。
⑶Z单质溶于X2Y中所得的新制溶液颜色为,该溶液具有漂白性是因为含有。
400 mL NaNO3和AgNO3的混合溶液中c(NO3—)=4mol/L,用石墨作电极电解此溶液,当通电一段时间后,两极均收集到11.2L气体(标准状况),假设电解后溶液体积仍为400 mL。回答下列问题:
(1)把下列电极方程式补充完整:
阴极:、2H++ 2e-= H2
阳极:
(2)上述电解过程中转移电子的物质的量为。
(3)电解后溶液中的c(H+)为
按下图装置进行实验,并回答下列问题
(1)判断装置的名称:A池为
(2)锌电极反应式为__________________
石墨棒C1为______极,电极反应式为__________
石墨棒C2附近发生的实验现象为______________
(3)当C2极析出2.24L气体(标准状态)时,锌的质量减少了__g.CuSO4溶液的质量增加了______g
为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的焓变,并采取相应措施。化学反应的焓变通常用实验进行测定,也可进行理论推算。
(1)实验测得,5g液态甲醇(CH3OH)在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,试写出甲醇燃烧的热化学方程式_________________。
(2)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程。在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量。
| 化学键 |
H-H |
N-H |
N≡N |
| 键能/kJ·mol-1 |
436 |
391 |
945 |
已知反应N2+3H2 2NH3△H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为________。
2NH3△H="a" kJ·mol-1。试根据表中所列键能数据估算a的数值为________。
(3)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的焓变进行推算。
已知:C(s,石墨)+02(g)=C02(g) △H1=-akJ·mol-1
2H2(g)+02(g)=2H20(l)△H2=-bkJ·mol-1
2C2H2(g)+502(g)=4C02(g)+2H20(l)△H3=-ckJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H=_________。
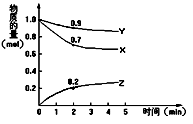
(4分)某温度时,2L容器中X、Y、Z三种物质的量随时间的变化如图所示。由图中数据分析,该反应的化学方程式为__;反应开始至2min ,Z的平均反应速率为。