(11分)有0.1mo l 的有机物和0.2mol的O2在密闭容器中燃烧后的产物为CO2、CO和H2O(气),产物通过浓H2SO4后,质量增加5.4g,再通过灼热的Fe2O3,充分反应后,氧化铁质量减轻了1.6g
l 的有机物和0.2mol的O2在密闭容器中燃烧后的产物为CO2、CO和H2O(气),产物通过浓H2SO4后,质量增加5.4g,再通过灼热的Fe2O3,充分反应后,氧化铁质量减轻了1.6g ;最后气体再通过碱石 灰完全吸收,质量增加8.8g。
;最后气体再通过碱石 灰完全吸收,质量增加8.8g。
(1)试推断该有机物的分子式 。
(2)若0.2mol的该有机物恰好与9.2g的金属钠完全反应,该有机物的结构简式为 。它在核磁共振氢谱中将会出现 个信号峰。
由A、B、C、D四种金属按下表中装置进行实验。
| 装置 |
 |
 |
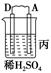 |
| 现象 |
二价金属A 不断溶解 |
C的质量 增加 |
A上有气 体产生 |
根据实验现象回答下列问题:
(1)装置甲中负极的电极反应式是_________________________________________。
(2)装置乙中正极的电极反应式是_________________________________________。
(3)装置丙中溶液的pH________(填“变大”、“变小”或“不变”)。
(4)四种金属活泼性由强到弱的顺序是_____________________________________。
(20 分)有4种钠的化合物W、X、Y、Z,它们之间存在如下关系:
①W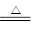 X+H2O+CO2↑②Z+CO2―→X+O2
X+H2O+CO2↑②Z+CO2―→X+O2
③Z+H2O―→Y+O2↑④X+Ca(OH)2―→Y+CaCO3↓
试回答下列问题:
(1)W、X、Y、Z的化学式分别是:W:______、X:______、Y:_______、Z:________。
(2)以上4个化学反应,属于氧化还原反应的是___________ (填反应序号),反应中氧化剂是__________ (写化学式),还原剂是__________ (写化学式)。
(3)若④反应在溶液中进行,写出其离子方程式以及能用该离子方程式表示的另一个化学反应的化学方程式:
①离子方程式:______________________________________________________。
②化学方程:_________________________________________________________。
(8 分)写出下列各离子反应方程式
(1)铝和氢氧化钠的反应
(2)氢氧化铝和盐酸的反应
(3)钠和盐酸的反应
(4)钠和硫酸铜的反应
(10 分)(1)明矾的组成为,明矾的用途,其在水中的电离方程式是。
(2)除去Na2CO3粉末中混入的NaHCO3杂质用 方法,化学方程式为 。
下列物质之间能够发生如下图所示的化学反应。合金由两种金属组成,取C溶液进行焰色反应,则火焰呈黄色。在反应中产生的水均未在图中标出。
(1)写出下列物质的化学式:
A,M,D,G。
(2)写出下列反应的化学方程式:
G→H。
M→D。
K→M。
(3)写出下列反应的离子方程式:
A→B+C。
K→D。
F→G 。