按照下列有关方法进行实验,实验结果偏大的是
| A.测定硫酸铜晶体中结晶水含量,失水后的硫酸铜置于空气中冷却后再测质量 |
| B.测定中和热实验中,所使用的NaOH稀溶液的物质的量浓度稍大于稀盐酸 |
| C.配制一定物质的量浓度溶液的实验中,容量瓶内壁附有蒸馏水 |
| D.用标准盐酸滴定未知浓度的氢氧化钠溶液,开始时俯视读数,终点时仰视读数 |
下列说法中,不正确的是( )
| A.NH3的水溶液可以导电,说明NH3是电解质 |
| B.明矾水解形成Al(OH)3胶体有吸附性,可用于水的净化 |
| C.二氧化硅可用于制造光导纤维 |
| D.向淀粉碘化钾溶液中加溴水,溶液变为蓝色,说明Br2的氧化性强于I2 |
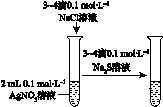
下图所示的实验,能达到实验目的的是
| A |
B |
C |
D |
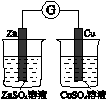 |
 |
 |
 |
| 验证化学能 转化为电能 |
证明温度 对平衡移动的影响 |
验证铁 发生析氢腐蚀 |
验证AgCl 溶解度大于Ag2S |
下列物质的转化在给定条件下能实现的是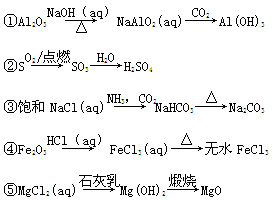
| A.①③⑤ | B.②③④ | C.②④⑤ | D.①④⑤ |
NaHCO3和Na2O2按1∶1的个数之比混合,在密闭容器中加热使之充分反应,然后趁热排出气体物质,容器内残留物的成分是
| A.Na2O2和NaHCO3 | B.NaHCO3和Na2CO3 |
| C.NaOH和Na2CO3 | D.只有Na2CO3 |
在一个绝热的密闭反应器中,只发生两个反应:
a(g)+b(g)  2c(g);ΔH1<0
2c(g);ΔH1<0
x(g)+3y(g)  2z(g);ΔH2>0
2z(g);ΔH2>0
进行相关操作且达到平衡后(忽略体积改变所作的功),下列叙述错误的是
| A.等容时,通入惰性气体,各反应速率不变 |
| B.等容时,通入z气体,y的物质的量浓度增大 |
| C.等压时,通入z气体,反应器中温度升高 |
| D.等压时,通入惰性气体,c的物质的量不变 |