向体积为2 L的密闭容器中充入2 mol SO2和1 mol O2,测得起始容器压强为p,一定条件下发生反应:2SO2(g)+O2(g)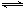 2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2 mol SO3,则下列说法正确的是
2SO3(g) △H=-196 kJ·mol-1,维持容器温度不变,测得平衡时容器内压强为0.7p,若此时再向容器中充入2 mol SO3,则下列说法正确的是
| A.充入2 mol SO3后,SO2的物质的量增大 |
| B.第一次反应达到平衡时共放出热量176.4 kJ |
| C.充入2 mol SO3达到新平衡时,容器内的压强为1.4p |
| D.降低容器的温度可使新平衡时各物质的体积分数与第一次平衡时相同 |
在MgCl2、KCl、K2SO4三种盐的混合溶液中,若K+、Cl-各为1.5 mol/L,Mg2+为0.5 mol/L,则SO42-的物质的量浓度为()
| A.0.1 mol/L | B.0.5 mol/L | C.0.15 mol/L | D.0.25 mol/L |
下列说法中正确是(NA表示阿伏加德罗常数)()
| A.4℃时,5.4mL水中所含的水分子数是0.3NA |
| B.在常温常压下,11.2L氯气所含的原子数为NA |
| C.标准状况下,22.4L氢气所含的质子数为2 2.4NA |
| D.2L 1mol·L-1K2SO4溶液中离子的总数为3 NA |
下列各组中,两种气体的分子数一定相等的是()
| A.温度相同、体积相同的O2和N2 | B.体积相等、密度不等的CO和C2H4 |
| C.质量相等、密度不等的N2和C2H4 | D.压强相同、体积相同的N2和O2 |
下列溶液中c(Cl-)最大的是()
| A.65mL1mol/L的KCl溶液 | B.25mL3mol/L的NaCl溶液 |
| C.20mL2mol/L的MgCl2溶液 | D.10mL1.5mol/L的AlCl3溶液 |
如图两瓶体积相等的气体,在同温、同压下瓶内气体的关系一定正确的是( )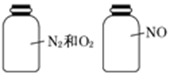
| A.原子数相等 | B.密度相等 | C.质量相等 | D.摩尔质量相等 |