已知通常情况下,1molC(石墨)完全燃烧生成CO2气体时放热393.5KJ,1molCO气体完全燃烧生成CO2气体时放热283.0KJ。下列说法正确的是
| A.石墨燃烧生成CO气体的热化学方程式为: 2C(石墨)+O2(g)=2CO(g)△H=-110.5kJ/mol |
| B.C(石墨)不完全燃烧,生成CO2和CO两种气体时,可放热283.0kJ |
| C.C(石墨)和CO2(g)反应生成CO(g)的反应是吸热反应 |
| D.若金刚石的燃烧生成CO2气体放出的热量大于石墨,则石墨变成金刚石的变化是放热反应 |
室温时10 mL某气态烃与过量的氧气混合,完全燃烧后的产物通过浓硫酸,再恢复至室温,气体体积减少了30 mL ,剩余气体再通过氢氧化钠溶液,体积又减少了40 mL ,则该气态烃的分子式为
| A.C4H6 | B.C2H4 | C.C3H8 | D.C4H8 |
有机物在反应中,常有下列原子间的共价键全部或部分断裂,如C—H、C—C、C=C、C—O、C═O等。下列各反应中,反应物分子中断裂键的排列,正确的组合是
| 化学反应 |
乙醇酯化 |
乙醇氧化 |
丙烷取代 |
乙酸酯化 |
丙烯加成 |
| A |
O—H |
C—H |
C—H |
C—O |
C=C |
| B |
O—H |
O—H |
C—C |
C═O |
C—H |
| C |
C—O |
C—O |
C—H |
O—H |
C—C |
| D |
C—O |
C—H |
C—C |
C—O |
C=C |
有四组同族元素的物质,在101.3 kPa时测定它们的沸点(℃)如下表所示:
| 第一组 |
He -268.8 |
(a) -249.5 |
Ar -185.8 |
Kr -151.7 |
| 第二组 |
F2 -187.0 |
Cl2 -33.6 |
(b) 58.7 |
I2 184.0 |
| 第三组 |
(c) 19.4 |
HCl -84.0 |
HBr -67.0 |
HI -35.3 |
| 第四组 |
H2O 100.0 |
H2S -60.2 |
H2Se -42.0 |
H2Te -1.8 |
下列各项中正确的是
| A.a、b、c的化学式分别为Ne2、Br2、HF |
| B.第二组物质只表现氧化性,不表现还原性 |
| C.第三组物质中C的沸点最高,是因为C分子内存在氢键 |
| D.第四组中各化合物的稳定性顺序为:H2O>H2S> H2Se>H2Te |
某有机物的结构是: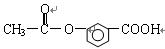
关于它的性质的描述正确的是
①能发生加成反应;②能溶解于NaOH溶液中;③能水解生成两种有机物;
④不能使溴水褪色;⑤能发生酯化反应;⑥有酸性
| A.①②③ | B.②③⑤ | C.仅⑥ | D.全部正确 |
惰性电极电解饱和食盐水,当溶液中有1mol NaOH生成时,则下列说法不正确的是
| A.阴极析出氢气 |
| B.标准状况下,阴极产生的气体为11.2L |
| C.阳极的电极反应式:2H2O + 2e- = 2OH-+ H2↑ |
| D.电路中有1mol电子通过 |