下列各反应的离子方程式中,正确的是:
| A.硫酸铝溶液中加入过量的氨水:Al3++3OH- ==Al(OH) 3 |
| B.铜与氯化铁溶液反应:Cu + Fe3+ ="=" Cu2+ + Fe2+ |
| C.NaHCO3溶液与NaHSO4溶液反应:HCO3- + H+= H2O + CO2 ↑ |
| D.常温下,Cl2与水的反应:Cl2 + H2O = 2H+ + Cl- + ClO- |
下图是Na、Cu、Si、H、C、N等元素单质的熔点高低的顺序,其中c、d均是热和电的良
导体。下列判断不正确的是
A.e、f单质晶体熔化时克服的是共价键
B.d单质对应元素原子的电子排布式:1s22s22p63s23p2
C.b元素形成的最高价含氧酸易与水分子之间形成氢键
D.单质a、b、f对应的元素以原子个数比1∶1∶1形成的分子中含2个σ键,2个π键
某元素的原子最外电子层排布是6s26p4,该元素或其化合物不可能具有的性质是
| A.该元素单质可能是导体 | B.该元素的最高化合价呈+6价 |
| C.该元素能与氢气反应生成气态氢化物 | D.该元素单质形成的晶体晶胞是简单立方 |
以下对核外电子运动状况的描述正确的是
| A.同一原子中,2p,3p,4p能级的轨道依次增多 |
B.当碳原子的核外电子排布由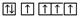 转变为 转变为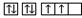 时,这一过程中释放能量 时,这一过程中释放能量 |
| C.3p2表示3p能级有两个轨道 |
| D.在同一能级上运动的电子,其运动状态可能相同 |
正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构。层内的H3BO3分子通过
氢键相连(如图)。下列有关说法正确的是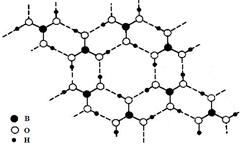
| A.正硼酸晶体属于原子晶体 |
| B.H3BO3分子的稳定性与氢键有关 |
| C.分子中B原子杂化轨道的类型为sp3 |
| D.含1molH3BO3的晶体中有3mol氢键 |
下列说法中正确的是
| A.二氯甲烷(CH2Cl2)分子的中心原子是SP3杂化,键角均为109°28′ |
| B.CH2O和ClO4– 的中心原子上都含有孤对电子 |
| C.BCl3、PCl5、H2O分子中均有一个原子的最外层电子不满足了8e-稳定结构 |
| D.由原子间通过共价键形成的晶体一定比其他类别晶体熔、沸点高 |