CuI是一种不溶于水的白色固体,它可由反应:2Cu2++4I-=2CuI↓+I2而得到。现用铜片、石墨作电极,电解KI溶液制取CuI。为确认反应情况,通电前在溶液中又加入了少量酚酞试液和淀粉溶液。电解一段时间后得到白色沉淀,同时阴极区溶液变红,阳极区溶液变蓝。下列说法正确的是
| A.铜片做阴极,石墨做阳极 |
| B.白色沉淀在阴极附近生成 |
| C.阳极区溶液变蓝的原因是:2Cu+4I--4e-=2CuI↓+I2,碘遇淀粉变蓝 |
| D.阳极区溶液变蓝的原因是:4OH--4e-=2H2O+O2↑,O2将I-氧化为I2,碘遇淀粉变蓝 |
对于锌、铜和稀硫酸组成的原电池(如图),下列有关说法正确的是()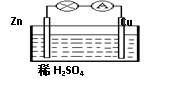
①Zn是负极②电子由Zn经外电路流向Cu
③Zn-2e-=Zn2+④溶液中H+向Zn棒迁移
| A.①② | B.①②③ |
| C.②③④ | D.①②③④ |
反应3X(g)+Y(g) 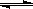 Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为()
Z(g)+2W(g)在2L密闭容器中进行,5min后Y减少了0.1mol,则此反应的平均速率v为()
| A.V(Y)=0.02mol·L—1·min—1 | B.V(Z)=0.10mol·L—1·min—1 |
| C.V(X) =0.03mol·L—1·min—1 | D.V(W)=0.02mol·L—1·s—1 |
用铁片稀H2SO4反应制取氢气时,下列措施不能使氢气生成速率加大的是()
| A.加热 | B.不用稀H2SO4改用98%的浓H2SO4 |
| C.滴加少量CuSO4溶液 | D.不用铁片,改用铁粉 |
已知断开1 mol H2中的化学键需要吸收436kJ的能量,断开1 mol Cl2中的化学键需要吸收243kJ的能量,而形成1mol HCl分子中的化学要释放431kJ的能量,则1mol氢气与1mol氯气反应时能量变化为( )
| A.吸收183kJ | B.吸收366kJ | C.放出183kJ | D.放出366kJ |
下列反应既属于氧化还原反应,又属于吸热反应的是( )
| A.铝片与稀盐酸的反应 | B.氢氧化钡晶体与氯化铵晶体的反应 |
| C.甲烷在氧气中的燃烧反应 | D.灼热的碳与二氧化碳的反应 |