下列分子式表示的物质,具有同分异构体的是
| A.C3H7Cl | B.C3H8 | C.CH2Cl2 | D.CH4O |
下列有关化学用语表示正确的是
A.质子数为53、中子数为78的碘原子: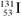 |
B.N2的电子式: |
C.S2-的结构示意图: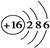 |
| D.丙醛的结构简式:CH3CH2COH |
21世纪化学的最新定义为“化学是一门创造新物质的科学”。下列有关说法不正确的是
| A.用CO2合成可降解的聚碳酸酯塑料,可以实现“碳”的循环利用 |
| B.开发利用太阳能、生物质能等清洁能源,有利于节约资源 |
| C.绿色化学的核心是应用化学原理对环境污染进行治理 |
| D.制备物质时探究反应中高的选择性、转化率和原子利用率,属于“绿色”的生产工艺 |
一定温度时,向容积为2L的密闭容器中充入一定量的SO2和O2,发生反应:2SO2(g)+O2(g) 2SO3(g)∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
2SO3(g)∆H=−196kJ·moL−1,一段时间后达平衡,反应过程中测定的部分数据见下表:
| 反应时间/min |
n(SO2)/mol |
n(O2)/mol |
| 0 |
2 |
1 |
| 5 |
1.2 |
|
| 10 |
0.4 |
|
| 15 |
0.8 |
下列说法不正确的是
A.反应在前5min的平均速率为v (SO2)=0.08mol·L−1·min−1
B.保持温度不变,向平衡后的容器中再充入0.2molSO2和0.2mol SO3时,v (正)>v (逆)
C.保持其他条件不变,若起始时向容器中充入2molSO3,达平衡时吸收78.4kJ的热量
D.相同温度下,起始时向容器中充入1.5mol SO3,达平衡时SO3的转化率为40%
下列溶液中各离子的浓度关系正确的是
| A.0.1 mol·L-1 CH3COONa溶液中:c(CH3COO-)+c(CH3COOH)="0.1" mol·L-1 |
| B.25℃时,等物质的量浓度的各溶液pH关系为:pH(Na2CO3)>pH(C6H5ONa)>pH(NaHCO3)>pH(CH3COONa) |
| C.25℃时,pH=9.4、浓度均为0.1 mol·L-1的HCN与NaCN的混合溶液中:c(Na+)>c(HCN)>c(CN-)>c(OH-) |
| D.将足量AgCl分别放入:①5m水,②10mL0.2mol/LMgC12,③20mL0.3mol/L盐酸中溶解至饱和,c(Ag+):①>②>③ |
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A |
测定等浓度的Na2CO3和Na2SO3 溶液的pH |
前者pH比后者的大 |
非金属性:S>C |
| B |
溴乙烷与NaOH溶液共热后,加入AgNO3溶液 |
未出现淡黄色沉淀 |
溴乙烷没有水解 |
| C |
向等浓度的KCl、KI混合液中滴加AgNO3溶液 |
先出现黄色沉淀 |
Ksp(AgCl)<Ksp(AgI) |
| D |
将KI和FeCl3溶液在试管中混合后,加入CCl4,振荡,静止 |
下层液体显紫红色 |
氧化性:Fe3+>I2 |