手性分子是指在分子结构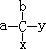 中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标记)不属于手性碳原子的是
中,当a、b、x、y为彼此互不相同的原子或原子团时,称此分子为手性分子,中心碳原子为手性碳原子。下列分子中指定的碳原子(用*标记)不属于手性碳原子的是
A.苹果酸 |
B.丙氨酸 |
C.葡萄糖 |
D.甘油醛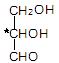 |
可逆反应2NO2 (g) 2NO (g) +O2 (g)在体积固定的密闭容器中,达到平衡状态的标志是
2NO (g) +O2 (g)在体积固定的密闭容器中,达到平衡状态的标志是
①单位时间内生成n mol O2的同时生成2n mol NO2
②单位时间内生成n mol O2的同时生成2n mol NO
③用NO2,NO,O2表示的反应速率的比为2:2:1的状态
④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态
⑥混合气体的压强不再改变的状态
⑦混合气体的平均相对分子质量不再改变的状态
| A.①④⑥⑦ | B.②③⑤⑦ | C.①③④⑤ | D.全部 |
已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是
| A.原子半径:A>B>D>C | B.原子序数:d>c>b>a |
| C.离子半径:C3->D->B+>A2+ | D.原子的最外层电子数目:A>B>D>C |
下列各组物质中化学键的类型相同的是
| A.HCl MgCl2 NH4Cl | B.H2O Na2O CO2 |
| C.CaCl2 NaOH H2O | D.NH3 H2O CO2 |
100 mL浓度为2 mol/L的硫酸跟过量的锌片反应,为加快反应速率,又不影响生成的氢气的总量,可采用的方法是
| A.加入适量的6 mol/L的硫酸 | B.适当加热 |
| C.加入适量蒸馏水 | D.加入适量的稀硝酸 |
一个原电池的总反应离子方程式是Zn+Cu2+=Zn2++Cu,该反应的原电池组成正确
| A |
B |
C |
D |
|
| 正极 |
Zn |
Ag |
Cu |
Cu |
| 负极 |
Cu |
Cu |
Zn |
Zn |
| 电解质溶液 |
CuCl2 |
H2SO4 |
CuSO4 |
FeCl2 |