与50ml 0.1mol/LNa2CO3溶液中Na+的物质的量浓度相同的是 (填代号)。
①25ml 0.2mol/L的NaCl溶液 ②100ml 0.1mol/L的NaCl溶液
③25ml 0.2mol/L的Na2SO4溶液 ④10ml 0.5mol/L Na2CO3溶液
用一只量筒收集CH4和Cl2的混合气倒扣在盛水的水槽中,用灯光照射量筒中的混合气体,一段时间后,可以观察到量筒内气体颜色,量筒壁上出现
,量筒内水面,量筒中的水溶液呈性。该反应的化学方程式是
(只写第一步)。
 已 知C分子结构中只含有一种氢。F为高分子化合物,结构为:
已 知C分子结构中只含有一种氢。F为高分子化合物,结构为: ,其他物质转化关系如下:
,其他物质转化关系如下:
乙苯+Cl2———→ A ———→ B —
⑤ F
C + Br2——③→ D ———→ E —
(1) C的结构简式是:,名称为:E的键线式为:
(2)框图中属于取代反应的是(填数字代号):
(3)写出②反应进行所需条件:
(4)写出反应④的化学方程式:
有机物键线式结构的特点是以线示键,每个折点和线端点处表示有一个碳原子,并以氢补足四价,C、H不表示出来。降冰片烷立体结构如图所示: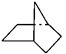
(1)写出其分子式。
(2)当降冰片烷发生一氯取代时,能生成种沸点不同的产物。
(3)根据降冰片烷的键线式结构,请你判断:降冰片烷属于。
a.环烷烃 b.饱和烃 c.不饱和烃 d.芳香烃
(4)降冰片烷具有的性质是。
a.能溶于水b.能燃烧c.能使酸性高锰酸钾溶液褪色
d.能发生加成反应 e. 能发生取代反应 f. 常温常压下为气体
有机化学中的反应类型较多,将下列反应归类(填序号)。
①由乙炔制氯乙烯②乙烷在空气中燃烧
③乙烯使溴的四氯化碳溶液褪色④二甲苯使酸性高锰酸钾溶液褪色
⑤由乙烯制聚乙烯⑥甲烷与氯气在光照的条件下反应
⑦由异戊二烯制橡胶⑧甲苯和浓硝酸浓硫酸100℃条件下反应
其中属于取代反应的是_________;属于氧化反应的是_______;属于加成反应的是_______;属于加聚反应的是________。写出⑧的反应方程式
(6分)150℃时,只含C、H、O三种元素的有机物A8.8g在一定量的O2中燃烧,生成的混合气体缓慢通过盛有足量无水CuSO4的干燥管,干燥管中的固体增重10.8g,剩余的气体通入盛有足量澄清石灰水的试剂瓶,试剂瓶中的物质增重8.8g,最后的气体缓慢通过盛有灼热CuO的硬质试管,硬质试管中的物质质量减少4.8g。请通过计算和分析回答下列问题:
⑴写有机物的分子式▲
⑵本题中,A和O2反应的化学方程式为▲;
⑶若A的结构满足下列条件:能和Na反应但不能和NaOH反应;能进行催化氧化但不能发生消去反应。则A的结构简式为▲;