芳香族化合物A的分子式为C7H6O2 ,那么包括A在内,属于芳香族化合物的同分异构体为 ( )
| A.5种 | B.4种 | C.3种 | D.2种 |
下列各组离子在指定的溶液中能大量共存的是
①无色溶液中:K+、Cu2+、Na+、SO42-
②pH=11的溶液中:CO32-、Na+、AlO2-、NO3-
③加入Al能放出H2的溶液中:Cl-、HCO3-、NO3-、NH4+
④在由水电离出的c(OH-)=10-13 mol·L-1的溶液中:Na+、Ba2+、Cl-、I-
⑤能使红色石蕊试纸变为蓝色的溶液:Na+、Cl-、S2-、ClO-
⑥酸性溶液中:Fe2+、Al3+、NO3-、Cl-
| A.①②⑤ | B.②④ | C.②④⑥ | D.③⑤⑥ |
德国著名行业杂志《应用化学》上刊登文章介绍:某中德联合研究小组设计制造了一种“水瓶”,用富勒烯(C60)的球形笼子作“瓶体”,一种磷酸盐作“瓶盖”,恰好可将一个水分子关在里面。下列说法正确的是
| A.水、双氧水、水玻璃都是纯净物 | B.石墨和C60互称为同位素 |
| C.磷酸钙是可溶性强电解质 | D.一定条件下石墨转化为C60是化学变化 |
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是
| A.根据纯净物的元素组成,将纯净物分为单质和化合物 |
| B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
| C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类 |
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是
| 编号 |
① |
② |
③ |
④ |
| 气体M |
H2S |
H2 |
NH3 |
NO |
| 气体N |
SO2 |
Cl2 |
HCl |
O2 |
A.①②③④B.①④③②C.②④①③D.④①②③
以NA表示阿伏加德罗常数,下列说法正确的是
| A.0.1 mol Fe与足量盐酸反应,转移的电子数为0.3 NA |
| B.28 g CO中所含的原子数为2 NA |
C.0.1 mol·L-1 Na2CO3溶液中,含有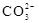 数为0.1 NA 数为0.1 NA |
| D.标准状况下,22.4 L苯的分子数为NA |