低碳经济呼唤新能源和清洁环保能源。煤化工中常需研究不同温度下的平衡常数、投料比及热值等问题。
已知:CO(g) + H2O(g) H2(g) + CO2(g)的平衡常数随温度的变化如下表:
H2(g) + CO2(g)的平衡常数随温度的变化如下表:
| 温度/℃ |
400 |
500 |
850 |
| 平衡常数 |
9.94 |
9 |
1 |
请回答下列问题:
(1)上述正反应方向是 反应(填“放热”或“吸热”)。
(2)850℃时在体积为10L反应器中,通入一定量的CO和H2O(g)发生上述反应,CO和H2O(g)浓度变化如下图,则0~4 min的平均反应速率v(CO)=______ mol/(L·min)
| 时 间(min) |
CO |
H2O |
CO2 |
H2 |
| 0 |
0.200 |
0.300 |
0 |
0 |
| 2 |
0.138 |
0.238 |
0.062 |
0.062 |
 3 3 |
C1 |
C2 |
C3 |
C3 |
| 4 |
C1 |
C2 |
C3 |
C3 |
| 5 |
0.116 |
0.216 |
0.084 |
|
| 6 |
0.096 |
0.266 |
0.104 |
|
| t1℃时物质浓度(mol/L)的变化 |
||||

(3) t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度变化如上表。
①表中3 min~4 min之间反应处于_____状态;C1数值_____0.08 mol/L (填大于、小于或等于)。
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是____(单选),表中5 min~6 min之间数值发生变化,可能的原因是______(单选)。
| A.增加水蒸气 | B.降低温度 | C.使用催化剂 | D.增加氢气浓度 |
(4)若在500℃时进行,若CO、H2O的起始浓度均为0.020mol/L,在该条件下,CO的最大转化率为: 。
(5)若在850℃进行,设起始时CO和H2O(g)共为5mol,水蒸气的体积分数为X;平衡时CO转化率为Y,试推导Y随X变化的函数关系式为 。
773 K、固定体积的容器中,反应CO(g)+2H2(g) CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。
CH3OH(g)过程中能量变化如下图。曲线Ⅱ表示使用催化剂时的能量变化。若投入a mol CO、2a mol H2,平衡时能生成0.1a mol CH3OH,反应就具工业应用价值。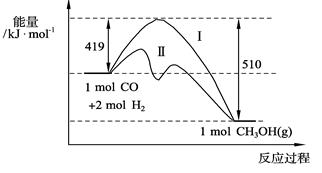
① 若按上述投料比使该反应具有工业应用价值,CO的平衡转化率最小为;
② 在容器容积不变的前提下,欲提高H2的转化率,可采取的措施(答两项即可)、;
③ 下列与催化剂有关的说法中,正确的是(填字母序号)。
a.使用催化剂,使反应CO(g)+2H2(g) CH3OH(g);ΔH>-91 kJ·mol-1
CH3OH(g);ΔH>-91 kJ·mol-1
b.使用催化剂, 能够提高反应物转化率
c.使用催化剂,不能改变反应的平衡常数K
下图是铜锌原电池装置。其电池的总反应是:Zn(s) + CuSO4(aq)="=" ZnSO4(aq) + Cu(s)。若该电池中两电极的总质量为300g,工作一段时间后,取出锌片和铜片洗净干燥后称重,总质量为298g。

请回答以下问题:
⑴R的名称是___________,其作用是__________________。R中的阳离子移向___________(填A或B)中的溶液。
⑵电极Y的材料是________,B中的电解质溶液是________________。
⑶X为原电池的___极,其电极反应式是______________。
(4)产生铜的质量为;转移的电子的物质的量为。
(5)高铁酸盐在能源环保领域有广泛用途。我国学者提出用镍(Ni)、铁作电极电解浓NaOH溶液制备高铁酸盐Na2FeO4的方案,装置如右图所示。
① Fe电极作极(填“阴”或“阳”);
② Ni电极的电极反应式为:。
化学反应速率可通过实验测定。要测定不同反应时刻反应物或生成物的浓度,可通过观察和测量体系中的某一物质的相关性质,再进行适当的转换和计算。如比较锌粒与不同浓度硫酸反应时的速率,可通过测定收集等体积H2需要的________来实现;在KMnO4与H2C2O4反应中,可通过观察单位时间内________________变化来测定该反应的速率;在Na2S2O3+H2SO4→Na2SO4+S↓+SO2↑+H2O反应中,该反应的速率可通过___来测定。
某化学反应的反应物和产物如下:
A1+NaNO3+H2O→A1(OH)3+N2+NaA1O2应的氧化剂是。
该反应的氧化产物是。
反应过程中转移5mole,生成标况下N2的体积L。
配平该反应的化学方程式:
A1+NaNO3+H2O→A1(OH)3+N2+NaA1O2
t℃时,将3mol A和1mol B气体通入体积为2L的密闭容器中(容积不变),发生如下反应:3A(g)+B(g) xC(g),△H<0;在2min时反应达到平衡状态(温度不变)剩余了0.8molB,并测得C的浓度为0.4mol·L—1,请填写下列空白,并利用三段式写出①②的计算过程。
①从开始反应至达到平衡状态,求反应物A的平均反应速率和A的转化率。
②求x的值和t℃该反应的平衡常数K的值。
③若向原平衡混合物的容器中再充入4 mol C,在t℃时达到新的平衡,此时B的物质的量为n(B)=mol。