(一)含铜物质是化学中的重要试剂。例如利用新制氢氧化铜悬浊液验证葡萄糖的还原性。
新制氢氧化铜悬浊液的配制与应用:
(1)实验室制取新制氢氧化铜悬浊液的操作方法:在试管里加入10%的________溶液2mL,滴入2%的_________溶液4~6滴(以上选填“硫酸铜”或“氢氧化钠”),振荡即成。这样操作的目的_______________________________________________。
(2)下列各组物质的溶液仅用新制的氢氧化铜悬浊液(必要时可以加热)不能检验出来的是______。
| A.HCOOCH3,C6H5COOH,C6H5CH2OH |
| B.NaHSO4,BaCl2,Na2CO3,酚酞 |
| C.HCOOH,HCOONa,HCOOCH2CH3 |
| D.葡萄糖,CH2OHCHOHCH2OH |
(二)下图是某同学在实验室中制取Cl2的装置图: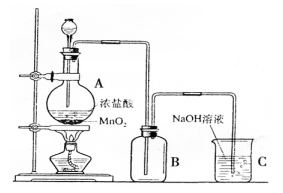
(1)该装置中的错误之处有二,分别是:
①
②
(2)试写出装置A和C中发生反应的离子方程式:
A处: ;C处: 。
在下列事实中,请填写出是什么因素影响了化学反应的速率:
(1)熔化的KClO3放出气泡很慢,撒入少量MnO2很快产生气体_____________
(2)将食物放入冰箱中保鲜,不易腐烂_______________________
(3)同样大小的锌粒分别与0.1mol/LHCl和1mol/LHCl反应,反应速率不同___________
(8分)氢氧燃料电池是符合绿色化学理念的新型发电装置.下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题:
(1)氢氧燃料电池的能量转化主要形式是____________________,在导线中电子流动方向为_________________(用a、b表示)。
(2)负极的电极反应式为____________________________________。
(3)电极表面镀铂粉的原因为______________________________ 。
(4)该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸收和放氢原理如下:
I、2Li+H2="2LiH" II、LiH+H2O=LiOH+H2↑
①反应I中的还原剂是_____________,反应中II的氧化剂是______________。
②已知用锂吸收224L(标准状况)H2,生成的LiH再与H2O作用,放出的H2用作电池燃料,若能量的转化率为80%,则导线中通过电子的物质的量为________________
如图所示,把试管放入盛有25℃时饱和石灰水的烧杯中,试管中开始放入几小块镁片,再用滴管滴入5ml盐酸于试管中,试回答下列问题: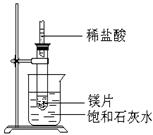
(1)实验中观察到的现象是
(2)产生该现象的原因
(3)写出有关反应的离子反应方程式
(4)有此推知,MgCl2溶等于液和H2的总能量 填 (“大于”“小于”或“”)镁片和盐酸的总能量
(共10分)已知某有机物中n(C): n(H)="1," 将W1g该有机物在足量氧气中充分燃烧,消耗标准状况下的氧气V L,产物只有CO2和H2O,且m(CO2)=w2g,m(H2O)=W3g。
(1)若通过计算来确定该有机物是否含氧,除已知的碳氢原子个数比外,还至少需上述数据中的 个,这几个数据的组合共有 种,将这些组合一一填入下列空格中。
说明:①选用V、W1、W2、W3表示,不必列出具体计算式;
②每个空格中填一种组合,有几种组合就填几种,不必填满。
(2)当W1与V之间满足 条件时,该有机物中一定没有氧原子,当W1与V之间满足 条件时,该有机物中一定含有氧原子。
(3)W1g有机物中含氧的质量为 g。(用含W1、W2的代数式表示)
(共9分)乙炔是一种重要的有机化工原料,以乙炔为原料在不同的反应条件下可以转化成以下化合物。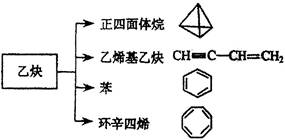
完成下列各题:
(1)正四面体烷的分子式为 ,其二氯取代产物有 种。
(2)关于乙烯基乙炔分子的说法正确的是 。
a. 能使酸性KMnO4溶液褪色
b. 1摩尔乙烯基乙炔能与3摩尔Br2发生加成反应
c. 乙炔其乙炔分子内含有两种官能团
d. 等质量的乙炔与乙烯基乙炔完全燃烧时的耗氧量不相同
(3)写出与环辛四烯互为同分异构体且属于芳香烃的所有分子的结构简式:
。
(4)写出与苯互为同系物且一氯代物只有两种的物质的结构简式(举两例)
(小于10个碳原子): , 。