纳米TiO2在涂料、光催化、化妆品等领域有着极其广泛的应用。
制备纳米TiO2的方法之一是TiCl4水解生成TiO2·x H2O,经过滤、水洗除去其中的Cl-,再烘干、焙烧除去水分得到粉体TiO2。
用氧化还原滴定法测定TiO2的质量分数:一定条件下,将TiO2溶解并还原为Ti3+,再以KSCN溶液作指示剂,用NH4Fe(SO4)2标准溶液滴定T i3+至全部生成Ti4+。
i3+至全部生成Ti4+。
请回答下列问题:
⑴ TiCl4水解生成TiO2·x H2O的化学方程式为_______________________________。
⑵检验TiO2·x H2O中Cl- 是否被除净的方法
是否被除净的方法 是______________________________。
是______________________________。
⑶配制NH4Fe(SO4)2标准溶液时,加入一定量H2SO4的原因是_________________;使用的仪器除天平、药匙、玻璃棒、烧杯、量简外,还需要下图中的_____(填字母代号)。
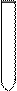



a b c d e
(4) 滴定终点的现象是___________________________________。
(5) 滴定分析时,称取TiO2(摩尔质量为M g·mol-1)试样w g,消耗c mol·L-1 NH4Fe(SO4)2标准溶液V mL,则TiO2质量分数表达式为_________________________。
(6) 判断下列操作对TiO2质量分数测定结果的影响(填“偏高”、“偏低”或“无影响”)
①若在配制标准溶液过程中,烧杯中的NH4Fe(SO4)2溶液有少量溅出,使测定结果_________________________。
②若在滴定终点读取滴定管刻度时,俯视标准液液面,使测定结果_________。
分类方法在化学学科的发展中起到重要的作用。下列分类标准合理的是
| A.根据纯净物的元素组成,将纯净物分为单质和化合物 |
| B.根据溶液导电能力强弱,将电解质分为强电解质、弱电解质 |
| C.根据是否具有丁达尔效应,将分散系分为溶液、浊液和胶体 |
| D.根据反应中的能量变化,将化学反应分为“化合、分解、复分解、置换”四类 |
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
| A.该硫酸的物质的量浓度为9.2 mol·L-1 |
| B.1 mol 铁加入到足量的该硫酸中,可产生2 g H2 |
| C.该硫酸与等质量的水混合所得溶液的物质的量浓度大于9.2 mol·L-1 |
| D.配制200 mL,4.6 mol·L-1的硫酸溶液需取该硫酸50 mL |
室温时,两个容积相同的烧瓶中分别盛有M和N两种气体(同温同压),取下弹簧夹A,使两烧瓶内的气体接触(如图),容器内的压强由大到小的顺序是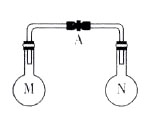
| 编号 |
① |
② |
③ |
④ |
| 气体M |
H2S |
H2 |
N H2 |
NO |
| 气体N |
SO2 |
Cl2 |
HCl |
O2 |
| A.①②③④ | B.②④①③ | C.④①②③ | D.①④③② |
以NA表示阿伏加德罗常数,下列说法正确的是
| A.0.1 mol Fe与足量盐酸反应,转移的电子数为0.3 NA |
| B.28 g CO中所含的原子数为2 NA |
C.0.1 mol·L-1 Na2CO3溶液中,含有 数为0.1 NA 数为0.1 NA |
| D.标准状况下,22.4 L苯的分子数为NA |
常温下,加水冲稀时c(H+)/c(OH-)的值明显减小的溶液中,一定能大量共存的离子组是
| A.②③ | B.①③⑤ | C.②④ | D.②③⑤ |