海洋中有丰富的食品、矿产、能源、药物和水产资源等(如下图所示)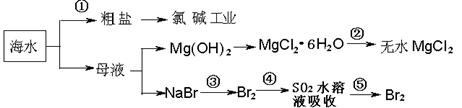
下列有关说法不正确的是
A.从能量转换角度来看,框 图中的氯碱工业是一个将电能转化为化学能量的过程 图中的氯碱工业是一个将电能转化为化学能量的过程 |
| B.过程②中结晶出的MgCl2·6H2O要在HCl氛围中加热脱水制得无水MgCl2 |
| C.在过程③⑤中溴元素均被氧化 |
D.过程①中除去粗盐中的SO42-、Ca2+、Mg2+、Fe3 + 等杂质,加入的药品顺 + 等杂质,加入的药品顺 序为: 序为: |
Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
NA为阿伏伽德罗常数,下列说法正确的是
| A.常温常压下,22.4L CO2中含有NA个CO2分子 |
| B.17.6g丙烷中所含的极性共价键为4NA个 |
| C.1.7g H2O2中含有的电子数为0.9 NA |
| D.在反应KIO3+6HI=KI+3I2+3H2O中,每生成3 mol I2转移的电子数为6NA |
实验室保存下列药品的方法,正确的是
| A.氢氟酸贮存在玻璃瓶里 |
| B.实验室盛放浓硫酸的广口瓶应当用磨口玻璃塞,不能用橡皮塞 |
| C.盛溴的试剂瓶里加一些水来防止溴挥发 |
| D.氯水保存在无色玻璃瓶中;液氯贮存在钢瓶里 |
化学在日常生活和生产中有着重要的应用。下列说法不正确的有
①明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化;②生活中常用苏打作发酵粉;③氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂;④燃煤时加入适量石灰石,可减少废气中SO2的量;⑤常温下浓硫酸可以用铁制容器盛放;⑥工业上常用硅制造光导纤维
| A.1个 | B.2个 | C.3个 | D.4个 |
如右图所示,集气瓶内充满某气体,置于明亮处,将滴管内的水挤入集气瓶后,烧杯中的水会进入集气瓶,集气瓶内气体可能是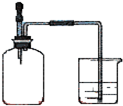
①NH3②N2、H2③NO2、O2④SO2⑤CH4、Cl2
| A.①②③④⑤ | B.①②④ | C.①③④⑤ | D.②③④ |
下列化学用语表达正确的是
| A.苏打溶液与稀盐酸反应的离子反应方程式:HCO3-+H+=== CO2↑+H2O |
| B.氨气溶于水显碱性的原因:NH3+ H2O === NH3·H2O ===NH4++ OH- |
C.饱和FeCl3溶液滴入沸水中制备Fe(OH)3胶体的离子方程式:Fe3++3H2O Fe(OH)3↓+3H+ Fe(OH)3↓+3H+ |
| D.CO2通入到纯碱饱和溶液中反应的化学方程式: Na2CO3+CO2+H2O === 2NaHCO3↓ |