2010年诺贝尔化学奖授予美日科学家,他们由于研究“有机物合成过程中钯催化交叉偶联”而获奖。钯的化合物氯化钯可用来检测有毒气体CO,发生反应的化学方程式为:CO+PdCl2 +H2O CO2 +Pd↓ +2HC1。下列说法正确的是 ( )
| A.题述反应条件下还原性:CO> Pd |
| B.题述反应中PdCl2被氧化 |
| C.生成22.4 L CO2时,转移的电子为2 mo1 |
| D.CO气体只有在高温下才能表现还原性 |
下列叙述正确的是
| A.K与N连接时,X为硫酸,一段时间后溶液的pH减小 |
| B.K与N连接时,X为氯化钠,石墨电极反应:2H++2e- = H2↑ |
| C.K与M连接时,X为氯化钠,石墨电极反应:4OH- -4e- =2H2O+O2↑ |
| D.K与M连接时,X为硫酸,一段时间后溶液的pH减小 |
某同学研究铝及其化合物的性质时设计了如下两个实验方案。
方案①:2.7 g Al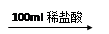 X溶液
X溶液 Al(OH)3沉淀
Al(OH)3沉淀
方案②:2.7 g Al Y溶液
Y溶液 Al(OH)3沉淀
Al(OH)3沉淀
NaOH溶液和稀盐酸的浓度均是3 mol/L,如图是向X溶液和Y溶液中分别加入NaOH溶液和稀盐酸时产生沉淀的物质的量与加入盐酸和氢氧化钠溶液体积之间的关系,下列说法正确的是
| A.X溶液溶质为AlCl3,Y溶液溶质为NaAlO2 |
| B.b曲线表示的是向X溶液中加入NaOH溶液 |
| C.在O点时两方案中所得溶液浓度相等 |
| D.a、b曲线表示的反应都是氧化还原反应 |
在一定条件下,固定容积的密闭容器中反应:2NO2(g) O2(g)+2NO(g) △H>0,达到平衡。当改变其中一个条件x,y随x变化符合图中曲线的是
O2(g)+2NO(g) △H>0,达到平衡。当改变其中一个条件x,y随x变化符合图中曲线的是
| A.当x表示温度时,y表示NO物质的量 |
| B.当x表示反应时间时,y表示混合气体的密度 |
| C.当x表示压强时,y表示NO2的转化率 |
| D.当x表示NO2物质的量时,y表示O2的物质的量 |
溶液中的反应:X+Y 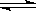 2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如右图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是
2Z分别在①、②、③三种不同实验条件下进行,它们的起始浓度均为c(X)=c(Y)=0.100mol/L及c(Z)=0mol/L,反应物x的浓度随时间变化如右图所示。②、③与①比较只有一个实验条件不同,下列说法不正确的是 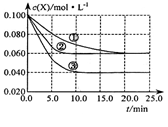
| A.前5min实验③的平均反应速率最快 | B.条件②的反应最先达到平衡 |
| C.②与①比较可能是压强更大 | D.该反应的正反应是吸热反应 |
某溶液中只存在OH-、H+、Cl-、NH4+ 四种离子,其离子浓度可能有如下关系。下列说法正确的是
①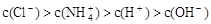 ②
②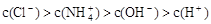
③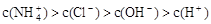 ④
④
| A.若①正确,则溶液中溶质一定为NH4Cl |
| B.溶质不同时,上述四种关系式均可能成立 |
| C.若④正确,且混合前盐酸和氨水体积相等,则盐酸中c(H+)等于氨水中c(OH-) |
D.若③正确,则溶液中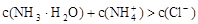 |