取两份铝片,第一份与足量盐酸反应,第二份与足量烧碱溶液反应,同温同压下放出相同体积的气体,则两份铝片的质量之比为
| A.1:1 | B.2:3 | C.3:2 | D.1:6 |
某同学通过系列实验探究Mg及其化合物的性质,操作正确且能达到目的的是
| A.将水加入浓硫酸中得到稀硫酸,置镁片于其中探究讨Mg的活泼性 |
| B.将NaOH溶液缓慢滴入MgSO4溶液中,观察Mg(OH)2沉淀的生成 |
| C.将Mg(OH)2浊液倒入装有滤纸的漏斗中,搅拌,静置,洗涤并收集沉淀 |
| D.将Mg(OH)2沉淀转入表面皿中,加足量稀盐酸,加热蒸干得无水MgCl2固体 |
用右图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
| 选项 |
①中物质 |
②中物质 |
预测②中的现象 |
| A |
稀盐酸 |
碳酸钠与氢氧化钠的混合溶液 |
立即产生气泡 |
| B |
浓硝酸 |
用砂纸打磨过的铝条 |
产生红棕色气体 |
| C |
氯化铝溶液 |
浓氢氧化钠溶液 |
产生大量白色沉淀 |
| D |
亚硫酸钠溶液 |
高锰酸钾酸性溶液 |
溶液逐渐褪色 |
120mL含有0.20mol碳酸钠溶液和200mL盐酸,不管将前者滴加入后者,还是将后者滴加入前者,都有气体产生,但最终生成的气体体积不同,则盐酸的浓度合理的是
| A.2.0mol/L | B.1.5 mol/L | C.0.18 mol/L | D.0.24mol/L |
下列有关物质的性质和该性质的应用均正确的是
| A.常温下浓硫酸能和铝发生钝化,可在常温下用铝制容器贮运浓硫酸 |
| B.二氧化硅不与任何酸反应,可用石英制造耐酸容器 |
| C.二氧化氯具有还原性,可用于自来水的杀菌消毒 |
| D.铜的金属活泼性比铁的弱,可在海轮外壳上装若干铜块以减缓其腐蚀 |
NaCl是一种化工原料,可以制备一系列物质(见下图)。下列说法正确的是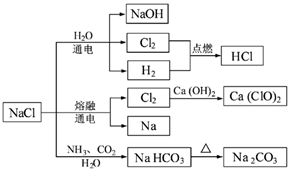
| A.25℃,NaHCO3在水中的溶解度比Na2CO3的大 |
| B.石灰乳与Cl2的反应中,Cl2既是氧化剂,又是还原剂 |
| C.常温下干燥的Cl2能用钢瓶贮存,所以Cl2不与铁反应 |
| D.图中所示转化反应都是氧化还原反应 |