向某晶体的水溶液中加入Fe2+的溶液后,无明显变化,当滴加几滴氯水后,混合液出现红色。那么,由此得出下列的结论错误的是
| A.该晶体中一定含有SCN- | B.Fe3+的氧化性比Cl2的氧化性强 |
| C.Fe2+被Cl2氧化为Fe3+ | D.Fe2+与SCN-不能形成红色的化合物 |
一种“即食即热型快餐”适合外出旅行时使用。其内层是用铝箔包裹的、并已加工好的真空包装食品,外层则是分别包装的两包化学物质,使用时拉动预留在外的拉线,使这两种化学物质反应,此时便可对食物进行加热,这两包化学物质最合适的选择是
| A.浓硫酸与水 | B.熟石灰与水 |
| C.生石灰与水 | D.氯化钠与水 |
下列说法正确的是
| A.热化学方程式中,如果没有注明温度和压强,则表示反应热是在标准状况下测得的 |
| B.升高温度或加入催化剂,可以改变化学反应的反应热 |
| C.据能量守恒定律,反应物的总能量一定等于生成物的总能量 |
| D.物质发生化学变化一定伴随着能量变化[ |
已知H2(g)+Br2(l)=2HBr(g);△H=-72kJ/mol.蒸发1mol Br2(l)需要吸收的能量为30kJ,其它相关数据如下表:
| 化学物质 |
H2(g) |
Br2(g) |
HBr(g) |
| 1mol分子中的化学键断裂时需要吸收的能量/KJ |
436 |
a |
369 |
则表中a为
A.404B.260C.230D.200
化学反应N2+3H2 2NH3的能量变化下图所示,该反应的热化学方程式是
2NH3的能量变化下图所示,该反应的热化学方程式是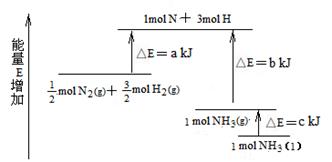
A.N2(g)+3H2(g)  2NH3(1);△H=2(a-b-c)kJ·mol-1 2NH3(1);△H=2(a-b-c)kJ·mol-1 |
B.N2(g)+3H2(g)  2NH3(g);△H=-2(b+a)kJ·mol-1 2NH3(g);△H=-2(b+a)kJ·mol-1 |
C.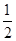 N2(g)+ N2(g)+ H2(g) H2(g)  NH3(1);△H=(b+c-a)kJ·mol-1 NH3(1);△H=(b+c-a)kJ·mol-1 |
D.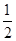 N2(g)+ N2(g)+ H2(g) H2(g)  NH3(g);△H=(a+b)kJ·mol-1 NH3(g);△H=(a+b)kJ·mol-1 |
把0.6molX气体和 0.4molY气体混和于2 L密闭容器中发生反应:
3X(g)+Y(g) nZ(g)+2W(g)5 min末生成0.2molW,若测知以Z浓度变化表示的反应平均速率为0.01mol·L-1·min-1,则上述反应中化学计量数n值是
nZ(g)+2W(g)5 min末生成0.2molW,若测知以Z浓度变化表示的反应平均速率为0.01mol·L-1·min-1,则上述反应中化学计量数n值是
| A.1 | B.2 | C.3 | D.4 |