若30g密度为d g/mL的AlCl3的溶液中含有0.9g Al3+(不考虑Al3+与水反应),则Cl-浓度为
A.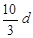 mol/L mol/L |
B.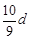 mol/L mol/L |
C.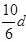 mol/L mol/L |
D.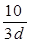 mol/L mol/L |
下列装置或操作不能达到实验目的的是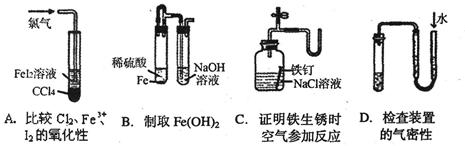
用NA表示阿伏加德罗常数的值。下列叙述正确的是()
| A.3.6 g碳与3.36 L O2一定条件下恰好完全反应,生成CO分子数一定为0.3NA |
| B.6.9 g钠与足量的CO2和H2O (g)混合气体充分反应,转移的电子数一定为0.3NA |
| C.25℃时, 0.15mol/L的Na2CO3溶液中,Na+数目为0.3NA |
| D.标准状况下,2.24L氯仿中含有C-Cl数目为0.3NA |
下列化学用语表示正确的是()
A.NaH与重水反应的方程式:NaH+D2O=NaOH+D2↑ |
B.三氟化氮的电子式: |
| C.熔融状态下硫酸氢钠的电离方程式:NaHSO4(熔融)=Na++HSO4- | |
D.质量数为137的钡原子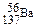 |
在25℃时,用石墨电极电解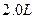 ,
,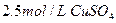 溶液。5min后,在一个石墨电极上有6.4g Cu生成。试回答:
溶液。5min后,在一个石墨电极上有6.4g Cu生成。试回答:
(1)转移电子的物质的量,得到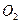 的体积(标准状况),溶液的
的体积(标准状况),溶液的 ?
?
2)如用等质量的两块铜片代替石墨作电极,电解后两铜片的质量相差多少?电解液的 是否变化?(相对原子质量 Cu:64)
是否变化?(相对原子质量 Cu:64)
某学生欲用已知物质的量浓度的HCl测定未知浓度的NaOH溶液,将HCl置于滴定管,氢氧化钠溶液置于锥形瓶,选择酚酞作指示剂。请填写下列空白:
(1)用标准的盐酸滴定未知浓度的NaOH溶液,滴定到终点时锥形瓶中颜色变化为 。
(2)下列操作中可能无法会怎样影响所测NaOH溶液浓度(填偏大.偏小或不影响)
A.酸式滴定管未用标准浓度的HCl润洗就直接注入标准盐酸
B.读数时,开始平视,结束时俯视 液面
液面
(3)某学生根据3次实验记录有关数据如下:
| 滴定次数 |
待测NaOH溶液体积(mL) |
0.1000mol/L HCl溶液的体积(mL) |
|
| 滴定前刻度 |
滴定后刻度 |
||
| 第一次 |
25.00 |
0.00 |
26.11 |
| 第二次 |
25.00 |
1.56 |
30.30 |
| 第三次 |
25.00 |
0.22 |
26.31 |
请选择合理的数据计算NaOH溶液的物质的量浓度:c(NaOH)=________________。