标准状况下VL氨气溶解在1L水中(水的密度近似为1g/ml),所得溶液的密度为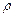 g/ml,质量分数为w,物质浓度为c mol/L,则下列关系中不正确的是
g/ml,质量分数为w,物质浓度为c mol/L,则下列关系中不正确的是
A.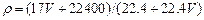 |
B.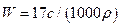 |
C.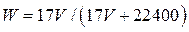 |
D.C="1000Vρ/(17V+22400)" |
下列溶液中的氯离子数目与50 mL 1 mol·L-1的AlCl3溶液中氯离子数目相等的是()
| A.100 mL 1 mol·L-1的NaCl | B.75 mL 2 mol·L-1的NH4Cl |
| C.150 mL 3 mol·L-1的KCl | D.75 mL 2 mol·L-1的CaCl2 |
下列物质中属于电解质的是()
| A.铁 | B.酒精 | C.二氧化碳 | D.氯化氢 |
已知丙酮是一种有机化合物,为无色液体,易溶于水,密度小于1 g/cm3,
沸点约为55℃,要从丙酮和水的混合物中将丙酮分离出来,下列方法中最合理的是()
| A.蒸馏 | B.分液 | C.过滤 | D.结晶 |
海水淡化可采用膜分离技术。如右图所示,对淡化膜右侧的海水加压,水分子可以透过淡化膜进入左侧淡水池,而海水中其它各种离子不能通过淡化膜,从而得到淡水。对加压后右侧海水成分变化分析正确的是()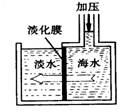
| A.溶质质量增加 | B.溶剂质量减少 |
| C.溶液质量不变 | D.溶质质量分数减少 |
为了除去粗盐中Ca2+、Mg2+、SO2-4及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是 ①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液()
| A.①④②⑤③ | B.④①②⑤③ | C.②⑤④①③ | D.⑤②④③① |