亚氨基羟(Li2NH)是一种储氢容量器,安全性好的固体储氢材料,其储氢原理可表示为Li2NH+H2=LiNH2+LiH。下列有关说法正确的是
| A.Li2NH中N的化合价是-1 | B.该反应中H2既是氧化剂又是还原剂 |
| C.Li+和H-的离子半径相等 | D.此法储氢和钢瓶储氢的原理相同 |
25℃时,某硫酸铜溶液的溶质质量分数为w,物质的量浓度为cmol/L,密度为ρg/mL,将此溶液蒸去a g水或再向原溶液中加入b g无水硫酸铜粉末,充分静置并恢复至25℃时,均恰好全部转化为CuSO4·5H2O晶体。则下列关系式正确的是()
A. |
B.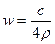 |
C.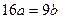 |
D.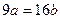 |
关于下列各图的叙述正确的是()
A.甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ·mol-1
B.乙表示恒温恒容条件下发生的可逆反应2NO2 N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
N2O4(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态
C.丙表示A、B两物质的溶解度随温度变化情况,将A、B饱和溶液分别由T1℃升温至T2℃时,溶质的质量分数B>A
D.丁表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则同浓度的NaA溶液的pH小于NaB溶液
铅蓄电池是典型的可充电电池,在现代生活中有着广泛的应用,其充电、放电按下式进行:
有关该电池的说法正确的是()
| A.放电时,蓄电池内电路中H+ 向负极移动 |
| B.放电时,每通过1mol电子,蓄电池就要消耗2mol H2SO4 |
| C.充电时,阳极反应:PbSO4 +2e- = Pb + SO42- |
| D.充电时,铅蓄电池的负极与外接电源的负极相连 |
近年来,我国储氢碳纳米管研究获重大进展,电弧法合成的碳纳米管,常伴有大量的碳纳米颗粒生成。这种碳纳米颗粒可用氧化气化法提纯。其反应的离子方程式为(其中a、b、c、d、e 、f为反应计量数):aC + bCr2O72-+ cH+ = dCO2↑+ eCr3+ + f H2O。有关上述反应的叙述中正确的是()
| A.当a = 3时,e =" 2" |
| B.反应中既可用稀硫酸又可用浓硝酸酸化 |
| C.若产生11 g气体物质,则有6.02×1023个电子发生转移 |
| D.反应计量数b、c、e有如下关系:3e ="2b" + c |
化学实验中有时需要将某些溶液或试剂进行酸化,下列酸化方法正确的是()
| A.检验C2H5Cl中的氯元素:先将C2H5Cl与NaOH溶液混合后加热,再加盐酸酸化 |
| B.提高KMnO4溶液的氧化能力:用盐酸将KMnO4溶液酸化 |
| C.鉴定溶液中是否有Fe2+:先将溶液用硝酸酸化,再加入KSCN溶液 |
| D.检验溶液中是否有SO42-:先将溶液用足量的盐酸酸化,再加入BaCl2溶液 |