两个体积相同的容器,一个盛有CO,另一个盛有N2和C2H4,在同温同压下两容器内的气体一定具有相同:①.原子总数②.质子总数③.分子总数④.质量()
| A.①② | B.②③ | C.①③ | D.③④ |
下列说法正确的是 ( )
| A.2mol的盐酸 | B.0.1mol氢 | C.0.3molHCl | D.4mol的氧元素 |
将5mol/L的Mg(NO3)2溶液a mL稀释至b mL,稀释后溶液中NO3-的物质的量浓度为()
A. mol/L mol/L |
B.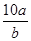 mol/L mol/L |
C.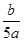 mol/L mol/L |
D.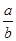 mol/L mol/L |
某10%NaOH溶液,加热蒸发掉100 g水后得到80 mL 20%的溶液,则该20%NaOH溶液的物质的量浓度为
| A.6.25 mol/L | B.12.5 mol/L | C.7 mol/L | D.7.5 mol/L |
要配制2 mol·L-1的NaOH溶液100mL,下面操作正确的是
| A.称取8g NaOH固体,放入烧杯里,用量筒量取100mL 蒸馏水倒入烧杯中,搅拌充分溶解 |
| B.称取8g NaOH固体,放入100mL量筒中,加水,充分溶解并稀释至100mL |
| C.称取8g NaOH固体,放入100mL容量瓶中,加蒸馏水溶解,再加水至刻度线,盖好瓶塞,反复摇匀。 |
| D.称取8g NaOH固体,放入烧杯里,加适量水溶解,将溶液转移到容量瓶中,洗涤烧杯和玻璃棒,把洗液一并转移到容量瓶中,再加水将溶液体积调至100mL |