一种新型燃料电池,它是用惰性金属作电极插入KOH溶液中,然后向两极上分别通入甲烷和氧气,发生的电极反应为:X极:CH4 + 10OH--8e-= CO32-+ 7 H2O Y极:2O2 + 4 H2O + 8e-=" 8" OH-;关于此燃料电池的说法不正确的是( )
| A.X极发生氧化反应,Y极发生还原反应 |
| B.工作一段时间后,KOH的物质的量减少 |
| C.该电池工作时通甲烷一极附近溶液的pH 升高 |
| D.在标准状况下通入5.6 L O2完全反应,则有1 mol电子发生转移 |
下列事实中,不能用勒夏特列原理解释的是
| A.高压有利于氨的合成 |
| B.实验室中常用排饱和食盐水的方式收集氯气 |
| C.打开汽水瓶,有气泡从溶液中冒出 |
| D.向双氧水中加入二氧化锰有利于氧气的生成 |
在一定温度下,可逆反应2A (g)+B (g) C (g)+D (g)达到平衡的标志是
C (g)+D (g)达到平衡的标志是
A.C的生成速率和B的消耗速率相等
B.v正(A)=2v正(B)
C.2v正(A)=v逆(B)
D.反应混合物中A、B、C、D的质量分数不再发生变化
化学反应的说法中,正确的是
| A.自发反应都是放热反应 |
| B.自发反应都是熵增大的反应 |
| C.能自发进行的吸热反应一定是熵增大的反应 |
| D.非自发反应在任何条件下都不能实现 |
质谱图表明某有机物的相对分子质量为70,红外光谱表征到C=C和C=O的存在,1H核磁共振谱如图(峰面积之比依次为1:1:1:3),下列说法正确的是
| A.分子中共有5种化学环境不同的氢原子 | B.该有机物的结构简式为CH3CH=CHCOOH |
| C.该物质的分子式为C4H6O | D.该有机物不可能与氢气反应 |
如图是用实验室制得的乙烯(C2H5OH 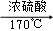 CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取1,2﹣二溴乙烷的部分装置图,根据图示判断下列说法正确的是
| A.装置①和装置③中都盛有水,其作用相同 |
| B.装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同 |
| C.产物可用分液的方法进行分离,1,2﹣二溴乙烷应从分液漏斗的上口倒出 |
| D.制备乙烯和生成1,2﹣二溴乙烷的反应类型分别是消去反应和加成反应 |