下图是生活中常用的锌锰干电池的示意图,下列有关说法中不正确的是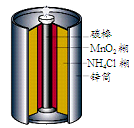
| A.电池内部含有电解质 | B.锌是负极,碳棒是正极 |
| C.电池用完后可埋入土壤 | D.锌锰干电池属一次电池 |
已知:CH4(g)+2O2(g)==CO2(g)+2H2O(1) △H1 = ―Q1 KJ/mol
2H2(g)+O2(g)==2H2O(g) △H2= ―Q2 KJ/mol, 2H2(g)+O2(g)==2H2O(1) △H3 = ―Q3KJ/mol
常温下,取体积比为4:1的甲烷和氢气的混合气体11.2L(已折合成标准状况),经完全燃烧后恢复至常温,则下列说法正确的是()
| A.放出的热量为(0.4Q1+0.05Q3)KJ/mol |
| B.放出的热量为(0.4Q1+0.05Q2)KJ/mol |
| C.△H2 > △H3 |
| D.△H2 <△H3 |
下列各组溶液,同时开始反应,出现浑浊最早的是
| A.20℃时 5mL 0.05mol·L-1 Na2S2O3溶液与5mL 0.1mol·L-1硫酸混合 |
| B.20℃时 50mL 0.1mol·L-1 Na2S2O3溶液与50mL 0.1mol·L-1硫酸混合 |
| C.10℃时 5mL 0.05mol·L-1 Na2S2O3溶液与5mL 0.1mol·L-1硫酸混合 |
| D.10℃时 5mL 0.1mol·L-1 Na2S2O3溶液与5mL 0.1mol·L-1硫酸混合 |
在2A+B  3C+4D中,表示该反应速率最快的是
3C+4D中,表示该反应速率最快的是
A.v(A) = 0.5mol·L-1·S-1 B.v(B) =" 0.3" mol·L-1·S-1
C.v(C) = 0.8mol·L-1·S-1 D.v(D)=" 1" mol·L-1·S-1
在一定条件下,反应N2+3H2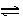 2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为()
2NH3,在2L密闭容器中进行,5min内氨的质量增加了1.7g,则反应速率为()
| A.V(H2)=0.03mol/(L·min) | B.V(N2)="0.02mol/(L·min)" |
| C.V(NH3)=0.17mol/(L·min) | D.V(NH3)=0.01mol/(L·min) |
灰锡(以粉末状存在)和白锡是锡的两种同素异形体。已知:①Sn(s、白)+2HCl(aq)=SnCl2(aq)+H2(g) △H1②Sn(s、灰)+2HCl(aq)=SnCl2(aq)+H2(g) △H2③Sn(s、灰) Sn(s、白)
Sn(s、白)
△H3=+2.1kJ/mol下列说法正确的是( )
| A.△H1>△H2 |
| B.锡在常温下以灰锡状态存在 |
| C.灰锡转化为白锡的反应是放热反应 |
| D.锡制器皿长期处于低于13.2℃的环境中,会自行毁坏 |