设NA表示阿伏加德罗常数,下列叙述中正确的是
| A.常温常压下,11.2L氧气所含的原子数为NA |
B.17g的NH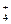 离子中含有的电子数为NA 离子中含有的电子数为NA |
| C.常温常压下,48gO3含有的氧原子数为3NA |
| D.24g金属镁变为镁离子时失去的电子数为NA |
CaC2、ZnC2、Al4C3、Li2C2等同属于离子型碳化物,请通过CaC2制C2H2的反应进行思考,从中得到必要的启示,判断下列反应产物正确的是
| A.CaC2水解生成乙烷 | B.ZnC2水解生成丙炔 |
| C.Al4C3水解生成甲烷 | D.Li2C2水解生成乙烯 |
向ZnSO4溶液中加入Na2S溶液时,得到白色沉淀,然后向白色沉淀上滴加CuSO4溶液,发现沉淀变为黑色,则下列说法不正确的是
| A.白色沉淀为ZnS,而黑色沉淀为CuS |
| B.上述现象说明ZnS的Ksp小于CuS的Ksp |
| C.利用该原理可实现一种沉淀转化为更难溶的沉淀 |
| D.该过程破坏了ZnS的溶解平衡 |
用乙炔为原料制取CH2Br—CHBrCl,可行的反应途径是
| A.先加Cl2,再加Br2 | B.先加Cl2,再加HBr |
| C.HCl,再加HBr | D.先加HCl,再加Br2 |
某pH=1的ZnCl2和HCl的混合溶液中含有FeCl3杂质,通过水解除去杂质,需将溶液调至pH=4,在调节溶液pH时,应选用的试剂是
| A.NaOH | B.ZnO | C.Na2CO3 | D.Fe2O3 |
据报道,近来发现了一种新的星际分子氰基辛炔,其结构式为:
HC≡C—C≡C-C≡C-C≡C-C≡N。对该物质判断正确的是
| A.不能使溴的四氯化碳溶液褪色 |
| B.能使酸性高锰酸钾溶液褪色 |
| C.不能发生加成反应 |
| D.可由乙炔和含氮化合物加聚制得 |