下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。常温常压下,A为无色有毒气体,B为红棕色粉末,C、E为金属单质。反应①②均为工业上的重要反应。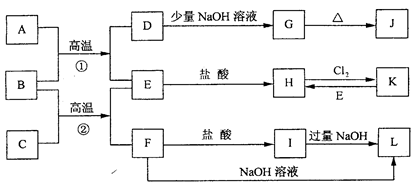
请回答下列问题:
(1)写出下列物质的化学式A K L 。
(2)写出F与NaOH反应的化学方程式 。
(3)写出B与C高温反应生成E和F的化学方程式: 。试列举该反应在工业生产中的应用 。
(4)写出D与J的稀溶液反应生成G的离子方程式: 。
(5)写出H与强碱反应后一段时间内所能观察出的现象 。
用
、
、
、
、
、
、
和
分别表示含有18个电子的八种微粒(离子或分子),请回答:
(1)
元素是、
元素是、
元素是(用元素符号表示)。
(2)
是由两种元素组成的双原子分子,其分子式是。
(3)
是所有含18个电子的微粒中氧化能力最强的分子,其分子式是。
(4)
是由两种元素组成的三原子分子,其分子式是,电子式是。
(5)
分子中含有4个原子,其分子式是。
(6)
分子中含有8个原子,其分子式是。
已知
、
、
、
和
5种分子所含原子的数目依次为1、2、3、4和6,且都含有18个电子。又知
、
和
是由两种元素的原子组成。请回答:
(1)组成
分子的原子的核外电子排布式是;
(2)
和
的分子式分别是和;
分子的立体结构呈形,该分子属于分子(填"极性"或"非极性");
(3)若向
的稀溶液中加入少量二氧化锰,有无色气体生成。则
的分子式是,该反应的化学方程式为;
(4)若将1 mol
在氧气中完全燃烧,只生成1 mol
和2 mol
,则
的分子式是。
(氮化硅(
)是一种新型陶瓷材料,它可由石英与焦炭在高温的氮气流中,通过以下反应制得:
+
+
 +
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
+
(1)配平上述反应的化学方程式(将化学计量数填在方框内);
(2)该反应中的氧化剂是,其还原产物是;
(3)该反应的平衡常数表达式为
=;
(4)若知上述反应为放热反应,则其反应热Δ
零(填"大于""小于"或"等于");升高温度,其平衡常数值(填"增大""减小"或"不变");
(5)若使压强增大,则上述平衡向反应方向移动(填"正"或"逆");
(6)若已知
生成速率为
=18
·(
)-1,
则
消耗速率为
=
·(
)-1。
下图中的
均为有机物
据上图回答问题:
(1)
的化学名称是。
(2)反应③的化学方程式是:(有机物须用结构简式表示)
(3)
的分子式是:
的结构简式是反应的反应类型是
(4)符合下列3个条件的
的同分异构体的数目有个
ⅰ)含有邻二取代苯环结构、 ⅱ)与
有相同官能团、ⅲ)不与
溶液发生显色反应。
写出其中任意一个同分异构体的结构简式
(5)
是的工业原料,用化学方程式表示
的一种的工业用途
某无色溶液,由Na+、Ag+、Ba2+、Al3+、AlO2-、MnO4-、CO32-、SO42-中的若干种组成。取该溶液进行如下实验:
(A)取适量试液,加入过量盐酸,有气体生成,并得到溶液;
(B)在(A)所得溶液中再加入过量碳酸氢铵溶液,有气体生成,同时析出白色沉淀甲;
(C)在(B)所得溶液中加入过量Ba(OH)2溶液,也有气体生成,并有白色沉沉乙析出。
根据上述实验回答下列问题:
(1)溶液中一定不存在的离子是。
(2)一定存在的离子是。
(3)判断沉淀乙成份的方法是。