用质量均为100 g的铜作电极,电解硝酸银溶液,电解一段时间后,两电极的质量差为28 g,此时两电极的质量分别为
| A.阳极100 g,阴极128 g | B.阳极93.6 g,阴极121.6 g |
| C.阳极91.0 g,阴极119.0 g | D.阳极86.0 g,阴极114.0 g |
将0.1mol Cu与40ml 10mol/LHNO3充分反应,测得反应后的溶液里含有a molH+
由此可知
| A.生成的气体一定是NO2,在标准状况下的体积4.48 L |
| B.生成的气体一定是NO,在标准状况下的体积约1.49L |
| C.被还原的硝酸的物质的量为(0.2-a)mol |
| D.反应后的溶液里含有0.2mol NO3- |
下表所列各组物质中,物质之间通过一步反应就能实现如图所示转化的是 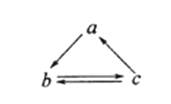
| 物质 选 项 |
a |
b |
c |
| A |
NO |
NO2 |
HNO3 |
| B |
Na2SiO3 |
Si |
SiO2 |
| C |
HCl |
HClO |
Cl2 |
| D |
S |
SO2 |
SO3 |
下列化学实验事实及其解释都正确的是
| A.过量的铜屑与稀硝酸作用,反应停止后,再加入1mol/L稀硫酸,铜屑又逐渐溶解是因为铜可直接与1mol/L稀硫酸反应 |
| B.铁钉放在浓硝酸中浸泡后,再用蒸馏水冲洗,然后放入CuSO4溶液中不反应,说明铁钉表面形成了一层致密稳定的氧化膜 |
| C.粗锌与稀硫酸反应制氢气比纯锌快,是因为粗锌比纯锌还原性强 |
| D.工业制玻璃的主要反应之一:高温下Na2CO3+SiO2=Na2SiO3+CO2↑ |
该反应原理可用“强酸H2CO3制弱酸H2SiO3”来解释
某溶液中可能含有I-、NH4+、Cu2+、SO32-,向溶液中加入少量溴水,溶液呈无色。
(提示:I2+SO2+2H2O==2HI+H2SO4)则下列关于溶液组成的判断正确的是
①肯定不含I- ②肯定不含Cu2+ ③肯定含有SO32- ④可能含有I-
| A.①② | B.①③ | C.②③④ | D.①②③ |
为提纯下列物质(括号内的物质是杂质),所选用的除杂试剂和分离方法都正确的是
| 被提纯的物质 |
除杂试剂 |
分离方法 |
|
| A |
溴化钠溶液(NaI) |
氯水、CCl4 |
萃取、分液 |
| B |
CO(CO2) |
饱和NaHCO3溶液 |
洗气 |
| C |
FeSO4(Fe2(SO4)3) |
足量铁屑 |
过滤 |
| D |
CO2(SO2) |
NaOH |
洗气 |