常温下,下列各组离子在指定溶液中可能大量共存的是
| A.澄清透明的溶液中:Cu2+、Fe3+、NO3-、Cl- |
| B.使pH试纸变蓝的溶液中:NH4+、Na+、SO42-、Cl- |
| C.含有大量ClO-的溶液中:K+、OH-、I-、SO32- |
D.c(Al3+) =" 0.1" mol·L-1的溶 液中:Na+、Cl-、AlO2-、SO42- 液中:Na+、Cl-、AlO2-、SO42- |
解释下列相应的实验事实方程式正确的是
| A.稀硫酸与氢氧化钡溶液恰好中和:Ba2++OH-+H+十SO42-= BaSO4↓+H2O |
B.测得0.1 mol/L氨水中C(OH-)为10-3 mol/L: NH3·H2O NH4++OH- NH4++OH- |
| C.在偏铝酸钠溶液中通入过量CO2出现白色沉淀:2AlO2-+ CO2 + 3H2O = 2Al(OH)3↓ + CO32- |
| D.碳酸氢钠溶液与过量石灰水混合出现白色沉淀:2HCO3-+ Ca2+ + 2OH- = CaCO3↓+ CO32-+2H2O |
下列实验过程中没有沉淀出现的是
| A.向常温时的饱和碳酸钠溶液中通入足量CO2气体 |
| B.向硅酸钠溶液中通入氯化氢气体 |
| C.向氯化钙和盐酸的混合溶液中通入SO2气体 |
| D.向硝酸银溶液中通入氯气 |
将某些化学知识用图像表示,可以收到直观、简明的效果。下列图象所表示的化学知识中,明显不正确的是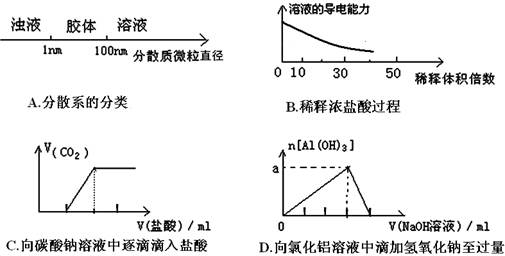
以下关于化学实验中“先”与“后”的说法正确的是
①加热试管时,先均匀加热,后局部加热
②做H2还原CuO实验时,先通H2,后加热CuO,反应完毕后,先撤酒精灯待试管冷却,后停止通H2
③制取气体时,先检查装置气密性,后装药品
④点燃可燃性气体如H2、CO等时,先检验气体纯度,后点燃
⑤制取蒸馏水时,先通冷却水,后加热烧瓶
⑥进行分液操作时,先从上口倒出上层液体,后从通过下端活塞放出下层液体
| A.①②③④ | B.①②③④⑤ | C.①②③④⑥ | D.全部 |
现有两瓶溶液,新制饱和氯水和亚硫酸溶液,下列方法或试剂(必要时可加热): ① 观察颜色 ② 石蕊试液 ③ 品红溶液,其中能用于鉴别它们的是
| A.①②③ | B.只有①③ | C.只有②③ | D.只有①② |