全世界每年铜的产量为8×106t,工业上由辉铜矿(主要成分是Cu2S,其中铜元素为+1价)生产铜的主要反应为:Cu2S+O2
| A.该反应中Cu2S只是还原剂 |
| B.每生产1molCu需转移2mol电子 |
| C.该反应中Cu2S既是氧化剂又是还原剂 |
| D.若用该反应生产铜,全世界每年产生的SO2的体积(标准状况)约为1.4×106L |
下列氮原子结构的表述中,对电子运动状态描述正确且能表明同一电子层电子能量有差异的是
A.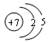 |
B.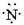 |
| C.1s22s22p3 |
D. |
下列每组物质发生所述变化克服的作用属于同种类型的是
| A.氯化铝和干冰升华 | B.钠和硫熔化 |
| C.食盐和氯化氢溶解于水 | D.二氧化硅和二氧化硫熔化 |
科技日报2007年1月30日讯:美、德两国科学家日前成功合成出具有独特化学特性的氢铝化合物(AlH3)n,其结构类似由硼和氢组成的硼烷,有关研究报告发表在最新出版的美国《科学》杂志上。最简单的氢铝化合物为Al2H6,它的熔点为150℃,燃烧热极高。Al2H6球棍模型如图。下列有关推测肯定不正确的是
| A.Al2H6跟水的反应可能是氧化还原反应,产物之一可能是氢氧化铝 |
| B.Al2H6在空气中完全燃烧,产物为氧化铝和水 |
| C.Al2H6分子是极性分子 |
| D.氢铝化合物可能成为未来的储氢材料和火箭燃料 |
设NA表示阿伏加德罗常数的值,下列叙述中正确的是
| A.常温常压下,20gD2O和足量的金属钠反应产生气体的分子数为0.5NA |
| B.1 mol Na2O2与足量的水反应,转移的电子数为2NA |
| C.NA个SO3分子在标准状况下的体积为22.4 L |
| D.25℃时,pH=13的1.0 L Ba(OH)2溶液中含有的OH-数目为0.2NA |
下列叙述正确的是
①氧化铝是一种比较好的耐火材料,可用来制造耐火坩埚
②氧化铁常用作红色油漆和涂料
③硅酸钠是制备硅胶和木材防火剂的原料
④以纯碱、石灰石、石英为原料可制普通玻璃
⑤石灰石、高岭石、石英和水晶的主要成分是SiO2
| A.①③④⑤ | B.②③④⑤ | C.①②④⑤ | D.①②③④ |