下列各组解释合理的是 ( )
| |
物质的检验、制备和用途及实验现象 |
解释 |
| A |
在一定浓度的乙酸溶液中加入少量乙酸钠固体,溶液pH增大 |
完全是由于乙酸根水解所致 |
| B |
向少量未知溶液中滴加氯化钡溶液,有白色沉淀生成 |
该溶液中一定含有SO2-4 |
| C |
常温下可用铁或铝制容器来盛装浓硫酸或浓硝酸 |
铁、铝表面发生了钝化现象 |
| D |
向饱和NaCl溶液中通入足量的NH3和CO2,有NaHCO3固体析出 |
NaHCO3是难溶于水的盐 |
现在有相同浓度的CH3COONa和NaClO溶液,两溶液中阴离子浓度的大小关系正确的是
| A.前者大于后者 | B.后者大于前者 | C.两者相等 | D.无法确定 |
下列有关化学平衡常数的描述中正确的是
| A.化学平衡常数的大小决定于化学反应的内因,与其他外界条件无关 |
B.相同温度下,反应A+B C与反应C C与反应C A+B的化学平衡常数相同 A+B的化学平衡常数相同 |
C.反应2SO2(g)+O2(g) 2SO3(g) △H<0的化学平衡常数随温度升高而增大 2SO3(g) △H<0的化学平衡常数随温度升高而增大 |
D.反应A(g)+B(g) 2C(g)的平衡常数表达式为K= 2C(g)的平衡常数表达式为K=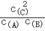 |
常温下,下列溶液中一定能大量共存的离子组是
| A.某溶液中加入铝粉产生气体:Na+、Al3+、Cl-、SO42- |
| B.在pH=1的溶液中:Na+、NH4+、AlO2-、Cl- |
| C.含有大量Fe2+的溶液中:K+、Mg2+、ClO-、SO42- |
| D.水电离产生的c(OH-)=1×10-10mol/L的溶液中:Na+、SO42-、NO3-、Cl- |
下列实验操作能达到实验目的的是
| A.检验SO42-离子的存在:在未知溶液中加入BaCl2溶液产生白色沉淀,再加入稀硝酸沉淀不消失 |
| B.检验Fe2+:向某溶液中加入2滴KSCN溶液,溶液不显红色。再向溶液中加入几滴新制的氯水,溶液变为红色,说明原溶液一定含有Fe2+ |
| C.检验某气体是SO2:将某未知气体通入到品红溶液中,溶液褪色,则该气体一定是SO2 |
| D.检验CO32-:在某未知溶液中加入盐酸产生无色无味的能使澄清石灰水变浑浊的气体,则一定含有CO32- |
美以三位科学家因“对核糖体结构和功能的研究”而获2009年诺贝尔化学奖,核糖体是进行蛋白质合成的重要细胞器;美国三位科学家因研究“染色体如何受到端粒和端粒酶的保护”而获2009年诺贝尔生理或医学奖。下列有关蛋白质的说法正确的是
A.蛋白质中一定含有C、H、O、P B蛋白质是人生命活动中最主要的能量物质
C.酶也是一种蛋白质 D蛋白质都能水解生成产物是一种氨基酸