(12分)某研究性小组进行如下实验:常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
| 实验编号 |
HA物质的量浓度(mol/L) |
NaOH物质的量浓度(mol/L) |
混合溶液的pH |
| ① |
0.1 |
0.1 |
pH=9 |
| ② |
c |
0.2 |
pH=7 |
| ③ |
0.2 |
0.1 |
pH<7 |
请回答:
(1)从①组情况分析,HA是强酸还是弱酸?__________(填“强酸”或“弱酸”)。
(2)②组情况表明,c____ 0.2 mol/L(填﹥、﹤或=)。混合液中离子浓度c(A-) c(Na+)(填﹥、﹤或=)。
(3)从③组实验结果分析,说明HA的电离程度______NaA的水解程度 (填﹥、﹤或=),该混合溶液中离子浓度由大到小的顺序是_____ ___。
(填﹥、﹤或=),该混合溶液中离子浓度由大到小的顺序是_____ ___。
(4)①组实验所得混合溶液中由水电离出的c(OH-)=____________mol·L-1。
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某化学研究小组利用软锰矿(主要成分为
,另含有少量头铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下简化流程既脱除燃煤尾气中的
,又制得电池材料
(反应条件已略去)。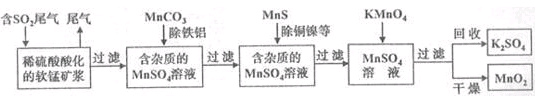
请回答下列问题:
(1)上述流程脱硫实现了(选填下列字母编号)。
A.废弃物的综合利用 B.白色污染的减少 C.酸雨的减少
(2)用
能除去溶液中
和
,其原因是。
(3)已知:25℃、101
时,
与
反应生成无水
的热化学方程式是。
(4)
可作超级电容器材料。用惰性电极电解
溶液可制得
,其阳极的电极反应式是。
(5)
是碱性锌锰电池的正极材料。碱性锌锰电池放电时,正极的电极反应式是。
(6)假设脱除的
只与软锰矿浆中的
反应。按照图示流程,将
(标准状况)含
的体积分数为
%的尾气通入矿浆,若
的脱除率为89.6%,最终得到
的质量为
,则除去铁、铝、铜、镍等杂质时,所引入的锰元素相当于
。
X、Y、Z、R为前四周期元素,且原子序数依次增大。XY2是红棕色气体;X与氢元素可形成XH3;Z基态原子的M层与K层电子数相等;R2+离子的3d轨道中有9个电子。请回答下列问题:
(1)Y基态原子的电子排布式是;Z所在周期中第一电离能最大的主族元素是。
(2)XY2-离子的立体构型是;R2+的水合离子中,提供孤电子对的是原子是。
(3)Z与某元素形成的化合物的晶胞如右图所示,晶胞中阴离子与阳离子的个数之比是。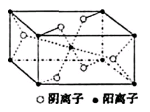
(4)将R单质的粉末加入XH3的浓溶液中,通入Y2,充分反应后溶液呈深蓝色,该反应的离子方程式是。
是一种治疗直肠癌和小细胞肺癌药物的主要成分,其结构式为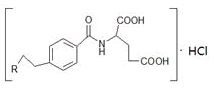 (不考虑立体结构,其中
为
(不考虑立体结构,其中
为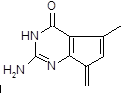 )。
的一条合成路线如下(部分反应试剂和条件略去)。
)。
的一条合成路线如下(部分反应试剂和条件略去)。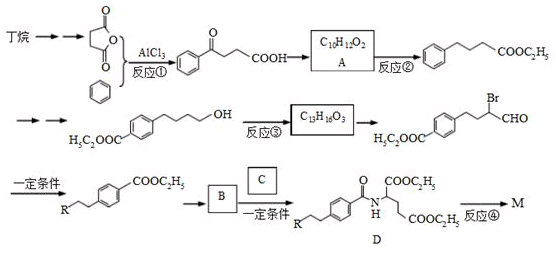
完成下列填空:
(1)写出反应类型。 反应①反应③
(2)写出反应试剂和反应条件。反应②反应④
(3)写出结构简式。
(4)写出一种满足下列条件的 的同分异构体的结构简式。
(1)能与
溶液发生显色反应;(2)能发生银镜反应;(3)分子中有5种不同化学环境的氢原子。
(5)丁烷氯代可得到2-氯丁烷,设计一条从2-氯丁烷合成1,3-丁二烯的合成路线。
(合成路线常用的表示方法为:A B……
B…… 目标产物)
目标产物)
(6)已知:
与
的化学性质相似。
从反应④可得出的结论是:。
许多有机化合物具有酸碱性。
完成下列填空:
(1)苯酚、苯甲醇、苯甲酸、碳酸的酸性由强到弱的顺序为:。苯胺(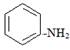 )具有。(相同"酸性"、"碱性"或"中性")
)具有。(相同"酸性"、"碱性"或"中性")
(2)常常利用物质的酸碱性分离混合液。某一混合液含苯酚、苯甲醇、苯甲酸和苯胺四种物质,其分离方案如下图: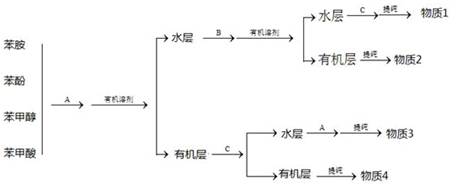
已知:苯甲醇、苯甲酸、苯胺微溶于水。
、
、
分别是:
上述方案中,若首先仅仅将苯甲酸与其他三种物质分开,则应加入。
(3)欲将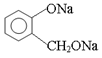 转化为
转化为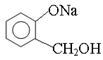 ,则应加入。
,则应加入。
硫在自然界中以游离态和多种化合态形成出现。硫的化合物大多具有氧化性或还原性。许多金属硫化物难溶于水。
完成下列填空:
(1)硫化氢具有还原性,可以和许多氧化剂反应。在酸性条件下,
和
反应生成
、
、
和
,写出该反应的化学方程式。
(2)石油化工的废气中有
。写出从废气中回收单质硫的两种方法(除空气外,不使用其他原料),以化学方程式表示。、
(3)室温下,0.1
的硫化钠溶液和0.1
的碳酸钠溶液,碱性更强的是,其原因是。
已知:
:
=1.3×10-7
=7.1×10-15
:
=4.3×10-7
=5.6×10-11
(4)向
溶液中滴加饱和
溶液,没有沉淀生成,继续滴加一定量的氨水后,生成
沉淀。用电离平衡原理解释上述现象。
(5)将黑色的 固体加入足量盐酸中,溶液中有淡黄色固体生成,产物还有、。过滤,微热滤液,然后加入过量的氢氧化钠溶液,可观察到的现象是。