金属的下列性质不能用金属晶体结构加以解释的是()
| A.有金属光泽 |
| B.易生锈 |
| C.易导电 |
| D.有延展性 |
按下列四种有关性质的叙述,可能属于金属晶体的是( )
| A.由分子间作用力结合而成,熔点很低 |
| B.固体或熔融后易导电,熔点在1000 ℃左右 |
| C.由共价键结合成网状晶体,熔点很高 |
| D.固体不导电,但溶于水或熔融后能导电 |
下面叙述所指的物质一定是金属单质的是( )
| A.具有金属光泽并能导电的固体 |
| B.晶体里有阳离子而没阴离子,具有延展性的固体 |
| C.单质跟碱溶液反应有氢气生成的固体 |
| D.具有显著还原性的固体 |
在金属晶体中,如果金属原子的价电子数越多,原子半径越小,自由电子与金属阳离子间的作用力越大,金属的熔沸点越高。由此判断下列各组金属熔沸点高低顺序正确的是( )
| A.Mg>Al>Ca | B.Al>Na>Li | C.Al>Mg>Ca | D.Mg>Ba>Al |
最近发现一种钛原子和碳原子构成的气态团簇分子,如图1-13所示,顶角和面心的原子是钛原子,棱的中心和体心的原子是碳原子,它的化学式为()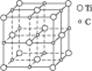
图1-13
| A.Ti14C13 | B.TiC |
| C.Ti4C4 | D.Ti4C3 |