下列说法正确的是(N0表示阿伏加德罗常数的值)
| A.在常温常压下,11.2L氯气含有的分子数为0.5N0 |
| B.在常温常压下,1mol氦气含有的原子数为2N0 |
| C.32g氧气含原子数目为2N0 |
| D.在标准状况下,1mol的水含有的体积约为22.4L |
一定温度下,向饱和NaOH溶液中投入一小块钠,充分反应后恢复到原温度。下列叙述中不合理的是( )
| A.NaOH溶液浓度增大,并放出H2 | B.溶液中NaOH的质量分数不变,有H2放出 |
| C.溶液的质量减小,有H2放出 | D.钠浮于液面,到处游动,发出嘶嘶的响声 |
把CO2通入含NaOH0.8g的碱溶液中,将产物在减压下蒸干后,得固体1.37g,则通入CO2的质量是( ).
| A.0.44g | B.0.66g | C.0.88g | D.都不是 |
下列说法正确的是( ).
①氯气的性质活泼,它与氢气混合后立即发生爆炸②实验室制取氯气时,为了防止环境污染,多余的氯气可以用氢氧化钙溶液吸收③新制氯水的氧化性强于久置氯水④检验HCl气体中是否混有Cl2,方法是将气体通入硝酸银溶液 ⑤除去HCl气体中的Cl2,可将气体通入饱和食盐水
| A.①②③ | B.②③④ | C.③ | D.③⑤ |
下列物质:①氢氟酸 ②浓H2SO4 ③烧碱溶液 ④Na2CO3固体 ⑤氧化钙 ⑥浓HNO3,其中在一定条件下能与SiO2反应的有( ).
| A.①③④⑤ | B.①②⑥ | C.全部 | D.②③⑥ |
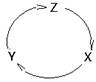
下表各组物质中,满足下图物质一步转化关系的选项是( ).