航天飞机用铝粉与高氯酸铵(NH4ClO4)的混合物为固体燃料,点燃时铝粉氧化放热引发高氯酸铵反应,其反应方程式表示为:2NH4ClO4=N2↑+4H2O+Cl2↑+2O2↑,该反应为放热反应.下列对此反应的叙述错误的是
| A.上述反应既是分解反应,又是氧化还原反应; |
| B.反应物的总能量小于生成物的总能量; |
| C.反应从能量变化上看,主要是化学能转化为热能和动能; |
| D.上述反应瞬间产生大量高温气体推动航天飞机飞行. |
用惰性电极电解一定浓度的硫酸铜溶液,通电一段时间后,向所得的溶液中加入0.1mol Cu2 (OH)2CO3后恰好恢复到电解前的浓度和pH值(不考虑二氧化碳的溶解)。则电解过程中共转移的电子数为()
| A.0.4mol | B.0.5mol | C.0.6mol | D.0.8mol |
据报道2008年11月9日德国科学家利用数亿个镍原子(28Ni)对数亿个(82Pb)连续轰击数天后制得一种新原子110X(暂用X表示),它属于一种新元素—第110号元素。这种新元素是有史以来制得最重的元素,存在时间不到千分之一秒。经推知它属于过渡元素。下列关于该元素的叙述中正确的是()
| A.这种原子(110X)的中子数为110 | B.这种元素肯定是金属元素 |
| C.这种元素与铅属同一族 | D.这种元素为第六周期元素 |
下列有关物质结构中的说法正确的是()
| A.78g Na2O2晶体中所含阴阳离子个数均为4NA |
| B.1.5g CH3+中含有的电子数为NA |
| C.3.4g氨气中含有0.6NA个N—H键 |
| D.PCl3和BCl3分子中所有原子的最外层都达到8电子稳定结构 |
常温常压下,某容器真空时质量为201.0g,当它盛满甲烷时质量为203.4g,而盛满某气体的质量为205.5g,则某气体可能是
| A.氧气 | B.氮气 | C.甲烷 | D.一氧化氮 |
《科学》评出2004年10大科技突破,其中“火星上‘找’到水的影子”名列第一。下列关于水的说法中错误的是
| A.用膜分离的方法可以使海水淡化 |
| B.高效催化剂可使水分解,同时释放能量 |
C.密度小于1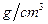 的溶液,浓度越大,密度越小 的溶液,浓度越大,密度越小 |
| D.金属的电化腐蚀中,水参与了正极反应 |