已知pH为4-5的条件下,Cu2+几乎不水解,而Fe3+几乎完全水解。某学生用电解纯净的CuSO4溶液的方法,并根据电极上析出Cu的质量(n)以及电极上产生气体的体积(V mL 标准状况)来测定Cu的相对原子质量,过程如下: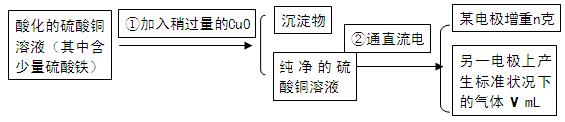
回答下列问题:
(1)加入CuO的作用是 。
(2)步骤②中所用的部分仪器如图所示,则A连直流电源的 极(填“正”或“负”)。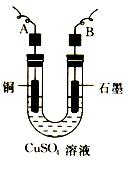
(3)电解开始后,在U形管中可以观察到的现象有:
电解的离子方程式(总反应)为
。
(4)下列实验操作中必要的是 (填写字母)。
| A.称量电解前的电极的质量; |
| B.电解后,电极在烘干称量前,必须用蒸馏水冲洗; |
| C.刮下电解后电极上析出的铜,并清洗,称量; |
| D.电解后烘干称重的操作中必须按“烘干→称量→再烘干→再称量”进行; |
(E)在有空气存在的情况下,烘干电极必须用低温烘干的方法。
(5)铜的相对原子质量为 (用带有m、V的计算式表示)。
实验目的:探究(一)同周期元素性质的递变规律
探究(二)影响化学反应速率的因素
供选试剂:锌片、锌粉、铁片、铁粉、镁条、铝条、新制Na2S溶液、新制氯水、
0.5mol/L盐酸、3mol/L盐酸等试剂(实验仪器自选)。
现有A同学设计的部分实验方案,请你帮他填写完整,并作出评价。
【实验探究一】同周期元素金属性和非金属性的递变规律
| 实验步骤 (画图表示,参照下图) |
实验现象 |
实验结论 |
|
| 非金属性递变 |
|||
| 金属性递变 |
【实验探究二】影响化学反应速率的因素
实验步骤 |
实验现象 |
实验结论 |
 (锌片和锌粉的质量相同,盐酸均过量) |
均有气体生成,锌粉比锌片消失快。 |
反应物接触面积越大,反应速率越快 |
A同学在[实验探究二]中所得结论不够严谨。原因是___________________________。
在不改变实验探究二所做实验的前提下,再补充一些实验即可完成有关探究,补充实验是(写最简方案,可不填满,也可增加):
①_________________________________;
②_________________________________;
③_________________________________。
(17分)某学习小组探究浓、稀硝酸氧化性的相对强弱,按下图装置进行实验(夹持仪器已略去)。实验表明浓硝酸能将NO氧化成NO2,而稀硝酸不能氧化NO。由此得出的结论是浓硝酸的氧化性强于稀硝酸。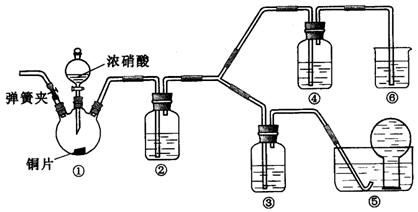
可选药品:浓硝酸、3 mol/L稀硝酸、蒸馏水、浓硫酸、氢氧化钠溶液及二氧化碳
已知:氢氧化钠溶液不与NO反应,能与NO2反应。
2NO2+2NaOH=NaNO3+NaNO2+H2O
(1)实验应避免有害气体排放到空气中。装置③、④、⑥中盛放的药品依次是___________。
(2)滴加浓硝酸之前的操作是检验装置的气密性,加入药品,打开弹簧夹后___________。
(3)装置①中发生反应的化学方程式是___________。
(4)装置②的作用是,发生反应的化学方程式是___________。
(5)该小组得出的结论所依据的实验现象是___________。
(6)实验结束后,同学们发现装置①中溶液呈绿色,而不显蓝色。甲同学认为是该溶液中硝酸铜的质量分数较高所致,而乙同学认为是该溶液中溶解了生成的气体。同学们分别设计了以下4个实验来判断两种看法是否正确。这些方案中可行的是(选填序号字母) ___________。
a.加热该绿色溶液,观察颜色变化
b.加水稀释该绿色溶液,观察颜色变化
c.向该绿色溶液中通入氮气,观察颜色变化
d.向饱和硝酸铜溶液中通人浓硝酸与铜反应产生的气体,观察颜色变化
用下图装置可以进行测定SO2转化成SO3的转化率的实验。已知SO3的熔点是16.8℃,沸点是44.8℃。已知发生装置中所涉及反应的化学方程式为:
Na2SO3(s) + H2SO4(98%)==Na2SO4 + H2O + SO2↑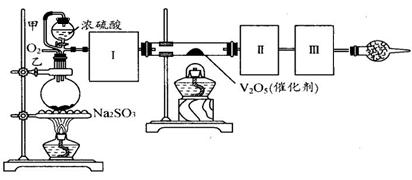
(1)根据实验需要,应该在Ⅰ、Ⅱ、Ⅲ处连接合适的装置。请从下图A~E装置中选择最适合装置并将其序号填入下面的空格中。Ⅰ、Ⅱ、Ⅲ处连接的装置分别是__、__、__。
(2)从乙处均匀通入O2,为使SO2有较高的转化率,实验中在加热催化剂与滴加浓硫酸的顺序中,应采取的操作顺序是。
(3)甲处导管的作用是。
(4)用amolNa2SO3粉末与足量浓硫酸进行此实验,当反应结束时,继续通入O2一段时间后,测得装置Ⅲ增重了bg,则实验中SO2的转化率为%(用含a、b的代数式填写)
(5)尾端球形干燥管的作用是。
20.6gNH4HCO3和NaHSO3的干燥粉状混合物,用加热分解的实验方法来测定NH4HCO3的质量分数。已知:NaHSO3加热时会产生SO2。根据下图所示的仪器和所盛试剂填空: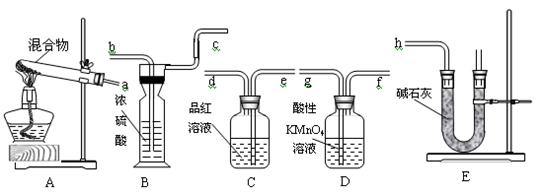
(1)按照气流由左→右的方向连接仪器的顺序(用a~h表示)为____________________。
(2)仪器B的名称为_________,E装置中放碱石灰的仪器名称为________,A和E装置中都用到的仪器名称为__________。
(3)D的作用是_______________________________________________________。
(4)C的作用是_________________________________;若C瓶中溶液颜色有变化,则测定结果可能会偏__________。
(5)B的作用是_____________________________________。
已知稀溴水和氯化铁溶液都呈黄色,现在足量的稀氯化亚铁溶液中,加入1~2滴液溴,振荡后溶液呈黄色。
(1)甲同学认为这不是发生化学反应所致,则使溶液呈黄色的微粒是:______ (填粒子的化学式,下同);乙同学认为这是发生化学反应所致,则使溶液呈黄色的微粒是_________;
(2)如果要验证乙同学判断的正确性,请根据下面所提供的可用试剂,用两种方法加以验证,请将选用的试剂代号及实验中观察到的现象填入下表。
实验可供选用试剂:
| A.酸性高锰酸钾溶液 | B.氢氧化钠溶液 | C.四氯化碳 |
| D.硫氰化钾溶液 E.硝酸银溶液 F.碘化钾淀粉溶液 |
| 实验方案 |
所选用试剂(填代号) |
实验现象 |
| 方案一 |
||
| 方案二 |
(3)根据上述实验推测,若在稀溴化亚铁溶液中通入氯气,则首先被氧化的离子是______,相应的离子方程式为;