甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g);△H=" +" 49.0 kJ·mol-1
②CH3OH(g)+1/2O2(g)=CO2(g)+2H2(g);△H=-192.9 kJ·mol-1
下列说法正确的是: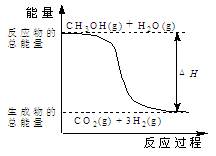
| A.CH3OH的燃烧热为192.9 kJ·mol-1 |
| B.反应中的能量变化可能如上图所示 |
| C.CH3OH转变成H2的过程一定要吸收能量 |
| D.根据②推知反应:CH3OH(l)+1/2O2(g)=CO2(g)+2H2(g)的△H>-192.9kJ·mol-1 |
下列有关氯气及其含氯分散系的说法正确的是
| A.钢铁在Cl2气氛中主要发生电化腐蚀 |
| B.在新制氯水中加入少量CaCO3,溶液中c(HClO)增大 |
| C.反应3Cl2(g) + 8NH3(g) = 6NH4Cl(s) + N2(g)的△H>0,△S<0 |
D.0.1mol·L-1NaClO溶液中:c(HClO) + c(H+) = c(OH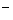 ) ) |
H2S废气资源化利用途径之一是回收能量并得到单质硫。反应原理为:2H2S(g) + O2(g) = S2(s) + 2H2O(l) △H=-632kJ·mol-1。右图为质子膜H2S燃料电池的示意图。下列说法正确的是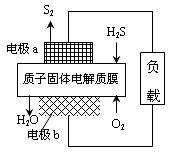
| A.电极a为电池的正极 |
B.电极b上发生的电极反应为:O2+2H2O+4e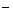 =" 4" OH =" 4" OH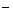 |
| C.电路中每流过4mol电子,电池内部释放632kJ热能 |
| D.每17gH2S参与反应,有1mol H+经质子膜进入正极区 |
下列指定反应的离子方程式正确的是
A.MnO2与浓盐酸混合加热:MnO2+4H++2Cl- Mn2++Cl2↑+2H2O Mn2++Cl2↑+2H2O |
| B.(NH4)2Fe(SO4)2溶液中加入过量的NaOH溶液:Fe2++2OH-=Fe(OH)2↓ |
| C.Ba(HCO3)2溶液中加入稀硫酸:Ba2+ + SO42-= BaSO4↓ |
| D.H2C2O4(弱酸)溶液中加入酸性KMnO4溶液:2MnO4-+ 5H2C2O4= 2Mn2+ + 10CO2↑+ 2H2O + 6OH- |
利用海洋资源获得的部分物质如下图所示,有关说法正确的是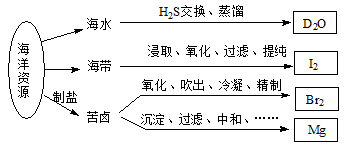
A.在化学反应中, H2O可转变为D2O H2O可转变为D2O |
| B.“加碘食盐”生产中碘添加剂为单质I2 |
| C.实验室用带玻璃塞的棕色瓶贮存液Br2 |
| D.电解饱和MgCl2溶液时在阴极得到Mg |
短周期主族元素X、Y、Z、W原子序数依次增大,X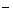 与氦原子电子层结构相同,Y原子核外L层电子数为8且Y与X同主族,Z原子的最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是
与氦原子电子层结构相同,Y原子核外L层电子数为8且Y与X同主族,Z原子的最外层电子数是内层电子总数的一半,W的最高正价与最低负价的代数和为4,下列说法正确的是
A.微粒半径:X<X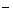 |
| B.简单氢化物的稳定性:Z比W的强 |
| C.W的氧化物的水化物的酸性一定比Z的强 |
| D.最外层电子数由大到小的顺序为:Z、W、Y |