一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其电离的离子间的溶解平衡关系:Ba(OH)2(固体) 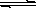 Ba2++2OH-。向此种悬浊液中加入少量的氧化钡粉末,下列叙述正确的是: ( )
Ba2++2OH-。向此种悬浊液中加入少量的氧化钡粉末,下列叙述正确的是: ( )
| A.溶液中氢氧根离子浓度增大 | B.溶液中钡离子浓度减少 |
| C.溶液中钡离子数目减小 | D.pH减小 |
下列说法正确的是
| A.向NaAlO2溶液中滴加NaHCO3溶液,有沉淀和气体生成 |
| B.0.1mol/LNaAlO2溶液中:H+、Na+、Cl-、SO42-能大量共存 |
| C.向明矾溶液中滴加Ba(OH)2溶液,恰好使SO42-完全沉淀完全: Al3+ +2SO42-+2Ba2++4OH- ===2BaSO4↓+AlO2-+2H2O |
| D.0.10mol/L的氨水与AlCl3溶液发生反应的离子方程式为Al3++3OH-===Al(OH)3↓ |
有关电解质的下列叙述正确的是
| A.甲酸溶液导电性比乙酸溶液导电性强,说明乙是弱酸 |
| B.氧化钾溶于水能导电,所以氧化钾是电解质 |
| C.强电解质一定是含有离子键,弱电解质中一定含弱极性共价键 |
| D.某物质能导电,说明该物质一定含有自由移动的微粒 |
近年来,加“碘”食盐较多的使用了碘酸钾(KIO3),碘酸钾在工业上可用电解法制取。以石墨和不锈钢为电极,以KI溶液为电解液,在一定条件下电解,反应方程式为:KI + 3H2O KIO3 + 3H2↑。下列有关说法正确的是
KIO3 + 3H2↑。下列有关说法正确的是
| A.电解时,石墨作阴极,不锈钢作阳极 |
| B.电解时,阳极反应是:I – – 6e – + 3H2O = IO3 – + 6H+ |
| C.溶液调节至强酸性,对生产有利 |
| D.电解前后溶液的pH变小 |
下列解释实验事实的方程式正确的是
| A.长期盛放石灰水的试剂瓶内壁出现白色固体:Ca(OH)2 + CO2 ==CaCO3↓+H2O |
| B.漂白粉溶液在空气中失效:ClO- +CO2 +H2O ="==" HClO + HCO3- |
| C.将氯气溶于水制备次氯酸:Cl2 +H2O ===2H+ + Cl- + ClO- |
| D.Ca(HCO3)2溶液与少量NaOH溶液反应:HCO3- +Ca2+ +OH- ="==" CaCO3↓+ H2O |
某小组设计如图装置(盐桥中盛有浸泡了KNO3溶液的琼脂)研究电化学原理,
下列叙述正确的是
| A.银片为负极,发生氧化反应 |
| B.进行实验时,盐桥中K+移向Mg(NO3)2溶液 |
| C.用稀盐酸代替AgNO3溶液,可形成原电池 |
| D.电流方向为从Mg→Ag |