合成氨工业对国民经济和社会发展具有重要的意义。其原理为:
N2(g)+3H2(g)  2NH3(g) △H=" -92.4KJ/mol " ,据此回答以下问题:
2NH3(g) △H=" -92.4KJ/mol " ,据此回答以下问题:
(1)下列有关该反应速率的叙述,正确的是(选填序号)  。
。
a.升高温度可以增大活化分子百分数,加快反应速率
b.增大压强不能增大活化分子百分数,所以不可以加快反应速率
c.使用催化剂可以使反应物分子平均能量升高,加快反应速率
d.在质量一定的情况下,催化剂颗粒的表面积大小,对反应速率有显著影响
(2)①该反应的化学平衡常数表达式为K=_______________________。
②根据温度对化学平衡的影响规律可知,对于该反应,温度越高,其平衡常数的值越_____ 。
(3)某温度下,若把10 mol N2与30 mol H2置于体积为10 L的密闭容器内,反应达到平衡状态时,测得平衡混合气体中氨的体积分数为20%,则该温度下反应的K=___________(可用分数表示)。能说明该反应达到化学平衡状态的是_________ (填字母)。
a.容器内的密度保持不变 b.容器内压强保持不变
c.υ正(N2)=2υ逆(NH3) d.混合气体中 c(NH3)不变
现有乙酸、苯、苯酚、苯甲酸四种有机物组成的混合物,可按右面的图示程序进行分离(已知苯甲酸是微溶于水的白色晶体)。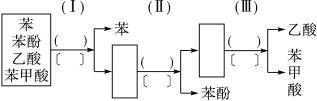
请在圆括号内填上适当的试剂名称,在方格号内填上分离操作的名称,在方框内填上适当物质的化学式。
20℃时,将10mL 0.1 mol/L  溶液和10mL 0.1mol/L的硫酸溶液混合,2 min后溶液明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那末50℃时,同样的反应要看到浑浊,需要的时间是___________s。
溶液和10mL 0.1mol/L的硫酸溶液混合,2 min后溶液明显出现浑浊。已知温度每升高10℃,化学反应速率增大到原来的2倍,那末50℃时,同样的反应要看到浑浊,需要的时间是___________s。
在锌与盐酸反应的实验中,一个学生得到的结果如下表所示:
| 锌的质量/g |
锌的形状 |
温度/℃ |
溶解于酸所花的时间/s |
|
| A |
2 |
薄片 |
5 |
400 |
| B |
2 |
薄片 |
15 |
200 |
| C |
2 |
薄片 |
25 |
100 |
| D |
2 |
薄片 |
35 |
50 |
| E |
2 |
薄片 |
45 |
25 |
| F |
2 |
粉末 |
15 |
5 |
试求:
(1)画一幅以时间对温度的曲线图(纵轴表示时间,横轴表示温度).
(2)利用所画的曲线图,关于温度影响反应速率你能得出什么结论?
(3)20℃时,2g锌箔溶解于酸中需花多少时间?
(4)对比结果B与F,解释F为什么那么快?
下图为将Zn投入一定浓度体积的H2SO4中,解释图像的成因(纵坐标为H2的生成速率)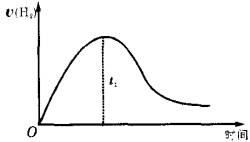
试将外界条件对化学反应速率的影响结果填入下表中。