过滤后的食盐水仍含有可溶性的CaCl2、MgCl2、Na2SO4等杂质,通过如下几个实验步骤,可制得纯净的食盐水:① 加入稍过量的Na2CO3溶液;② 加入稍过量的NaOH溶液;③ 加入稍过量的BaCl2 溶液;④滴入稀盐酸至无气泡产生;⑤ 过滤
正确的操作顺序是( )
| A.③②①⑤④ | B.①②③⑤④ | C.②③① ④⑤ ④⑤ |
D.③⑤②①④ |
水热法制备Fe3O4纳米颗粒的反应是3Fe2++2S2O +O2+xOH—
+O2+xOH—Fe3O4+S4O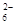 +2H2O下列说法中,正确的是
+2H2O下列说法中,正确的是
| A.每生成1mol Fe3O4,反应转移的电子总数为3mol |
B.Fe2+和S2O 都是还原剂 都是还原剂 |
| C.1mol Fe2+被氧化时,被Fe2+还原的O2的物质的量为1/3mol |
| D.x=6 |
下列现象或事实可用同一原理加以解释和说明的是
| A.氯化铵和碘都可以用加热法进行提纯 |
| B.浓硫酸和浓盐酸长期暴露在空气中浓度降低 |
| C.硫酸亚铁溶液和氢氧化钠溶液在空气中久置后均会变质 |
| D.二氧化硫气体均能使高锰酸钾溶液和溴水褪色 |
能说明镁比铝还原性强的事实是
| A.镁原子的价电子数比铝少 |
| B.镁遇冷浓硝酸和硫酸,表面不能钝化,而铝均能 |
| C.镁带能在空气中和在盛CO2的集气瓶里燃烧,而铝箔均不能 |
| D.铝的硬度、延展性、熔点均比镁大、好、高 |
下列各项操作中,发生“先产生沉淀,然后沉淀又溶解”现象的是 ① 向
① 向 Ca(ClO)2溶液中通入过量CO2② 向AlCl3溶液中逐滴加入过量氨水
Ca(ClO)2溶液中通入过量CO2② 向AlCl3溶液中逐滴加入过量氨水 ③ 向AgNO3溶液中逐滴加入过量氨水④ 向Na2SiO3溶液中逐滴加入过量的盐酸
③ 向AgNO3溶液中逐滴加入过量氨水④ 向Na2SiO3溶液中逐滴加入过量的盐酸 
| A.只有②③ | B.只有①③ | C.只有①②③ | D.①②③④ |
下列过程中,最终的白色沉淀不一定是BaSO4的是