下列是一系列α-氨基酸:
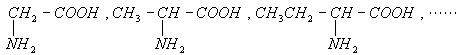
该系列中碳元素的质量分数的最大值接近于 ( )
| A.32% | B.46.6% | C.85.7% | D.92.3% |
下列溶液中有关物质的量浓度关系和计算不正确的是
A.c(NH4+)相等的(NH4)2SO4、(NH4)2Fe(SO4)2和NH4Cl溶液中,溶质浓度大小关系是:c[(NH4)2Fe(SO4)2] < c[(NH4)2SO4] < c(NH4Cl)
B.已知25°C时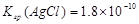 ,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到
,则在0.1mol·L-1AlCl3溶液中,Ag+的物质的量浓度最大可达到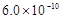 mol·L-1
mol·L-1
C.0.2mol·L-1 HCl溶液与等体积0.05 mol·L-1 Ba(OH)2溶液混合后,溶液的pH=1
D.室温下,0.1mol·L-1NaHA溶液的pH=4,则有C(HA-) >C(H+)>C(A2-)>C(H2A)
常温下,用0.1000 mol·L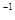 NaOH溶液滴定 20.00mL0.1000 mol·L
NaOH溶液滴定 20.00mL0.1000 mol·L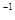
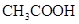 溶液所得滴定曲线如右图。
溶液所得滴定曲线如右图。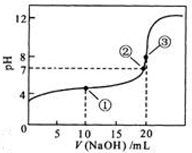
下列说法正确的是
A.点①所示溶液中: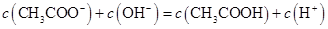 |
B.点②所示溶液中: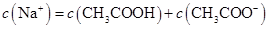 |
C.点③所示溶液中: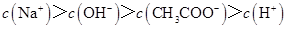 |
D.滴定过程中可能出现: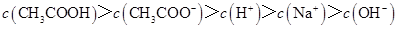 |
某温度下,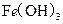
 、
、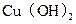 (s)分别在溶液中达到沉淀溶解平衡后,改变溶液
(s)分别在溶液中达到沉淀溶解平衡后,改变溶液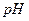 ,金属阳离子浓度的变化如图所示。
,金属阳离子浓度的变化如图所示。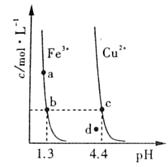
据图分析,下列判断错误的是
A.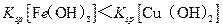 |
B.加适量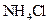 固体可使溶液由 固体可使溶液由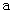 点变到 点变到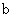 点 点 |
C.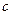 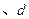 两点代表的溶液中 两点代表的溶液中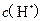 与 与 乘积相等 乘积相等 |
D.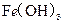 、 、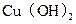 分别在 分别在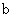 、 、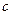 两点代表的溶液中达到饱和 两点代表的溶液中达到饱和 |
已知:(1)Zn(s)+1/2O2(g)=ZnO(s);△H=-348.3 kJ/mol;
(2)2Ag(s)+1/2O2(g)=Ag2O(s);△H=-31.0 kJ/mol。则Zn(s)+Ag2O(s)=ZnO(s)+2Ag(s)的△H等于
| A.-317.3 kJ/mol | B.-379.3 kJ/mol |
| C.-332.8 kJ/mol | D.317.3 kJ/mol |
下列叙述正确的是
A.电化学反应不一定是氧化还原反应 |
B.pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度相同 |
C.2NO+2CO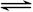 2CO2+N2的△H<0,则该反应一定能自发进行 2CO2+N2的△H<0,则该反应一定能自发进行 |
D.用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |