某课外活动小组将下图所示装置按一定顺序连接,在实验室里制取一定量的FeCl3(所通气体过量并充分反应)。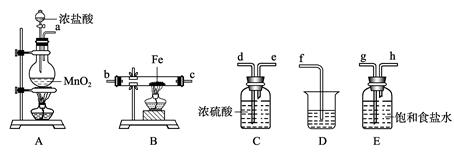
请回答下列问题:
(1) A中发生反应的化学方程式为______ _________________________________。
_________________________________。
(2)各装置的正确连接顺序为(填写装置代号)A→______→______→______→
______D。
(3)装置C的作用是________________________________________________,
写出装置D中反应的离子方程式___________ _________________________。
_________________________。
(4)反应开始后,B中硬质玻璃管内的现象为______________________________ ;
;
可以检验生成物中含有Fe3+的试剂是____________(填写试剂名称)。
(5) 该小组欲用下图所示装置收集尾气,并测量多余气体的体积。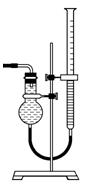
①若如 图所示量气装置由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是________(填“酸式”或“碱式”)滴定管。
图所示量气装置由干燥管、乳胶管和50 mL滴定管改造后组装而成,此处所用滴定管是________(填“酸式”或“碱式”)滴定管。
②为提高测量的准确性,上图装置中的液体可用________,
收集完气体后,读数前应进行的操作是____________。
③如果开始读数时操作正确,最后读数时俯视右边滴定管液面, 会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
会导致所测气体的体积__________(填“偏大”、“偏小”或“无影响”)。
|
实验室制取气体常用的装置如下列图示,请回答下列问题:(选用装置时填字母编号)

 ______________________,
______________________,
 满的方法:____________________________________________________;
满的方法:____________________________________________________;
下图表示配制 100 mL 0.100 mol·L-1 Na2CO3溶液的几个关键实验步骤和操作,据图回答下列问题: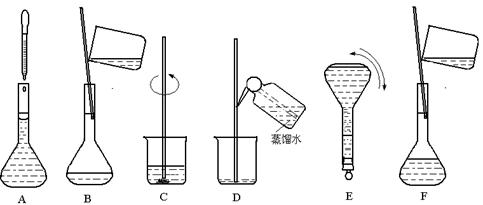
(1)步骤E中将一玻璃仪器上下颠倒数次,该仪器的名称是。
(2)步骤B通常称为转移,步骤A通常称为 。
。
(3)将上述实验步骤A→F按实验过程先后次序排列。
(10分)下图甲是课本中验证铜和浓硝酸反应的装置,乙、丙是师生对演示实验改进后的装置: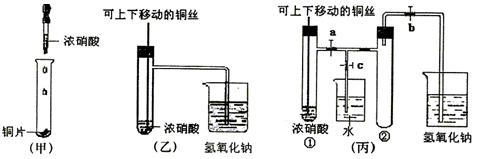
(1)写出铜和浓硝酸反应的离子方程式。
(2)和甲装置相比,乙装置的优点有
(3)为了进一步验证NO2和水的反应,某学生设计了丙装置,做实验时先关闭弹簧夹
,再打开弹簧夹,才能使NO2气体充满②试管。


(4)当气体充满②试管后,将铜丝提起与溶液脱离,欲使烧杯中的水进入②试管应如何操
作。
(5)②试管中的NO2和水充分反应后,所得溶液物质的量浓度的最大值是
(气体体积按标准状况计算)。
控制变量法是研究化学变化规侓的重要思想方法。请仔细观察
下表中50 mL稀盐酸和1g碳酸钙反应的实验数据:
| 实验 序号 |
碳酸钙 状态 |
c(HCl) /mol·L-1 |
溶液温度/℃ |
碳酸钙消失 时间/s |
|
| 反应前 |
反应后 |
||||
| 1 |
粒状 |
0.5 |
20 |
39 |
400 |
| 2 |
粉末 |
0.5 |
20 |
40 |
60 |
| 3 |
粒状 |
0.6 |
20 |
41 |
280 |
| 4 |
粒状 |
0.8 |
20 |
40 |
200 |
| 5 |
粉末 |
0.8 |
20 |
40 |
30 |
| 6 |
粒状 |
1.0 |
20 |
40 |
120 |
| 7 |
粒状 |
1.0 |
30 |
50 |
40 |
| 8 |
粒状 |
1.2 |
20 |
40 |
90 |
| 9 |
粒状 |
1.2 |
25 |
45 |
40 |
分析并回答下列问题:
(1)本反应属于________反应(填“吸热”或“放热”),反应的离子方程式为。
(2)实验6和7表明,_________对反应速率有影响,_________反应速率越快,能表明同一规律的实验还有_________(填实验序号)。
(3)根据实验1、3、4、6、8可以得出条件对反应速率的影响规律是。
(4)本实验中影响反应速率的其它因素还有__________,能表明这一规律的实验序号是1、2与_______。
(将下图所列仪器组装为一套实验室蒸馏石油的装置,并进行蒸馏,得到汽油和煤油。
(1)图中A、B、C三种仪器的名称是_________。。
(2)将以上仪器按(一)→(六)顺序,用字母a,b,c,…表示连接顺序:
e接( );( )接( );( )接( );( )接( );( )接( )
(3)A仪器中c口用于_________,d口用于_________。
(4)蒸馏时,温度计水银球应在_________位置。
(5)在B中注入原油后,加几片碎瓷片的目的是_________。