A、B、C、D、E五种短周期元素(A、B、C、D、E分别代表元素符号),它们的原子序数依次增大;A是元素周期表中原子半径最小的元素;B元素最高价氧化物对应的水化物与其氢化物反应生成一种盐X;
D与A同主族,且与E同周期;E 元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
元素原子的最外层电子数是其次外层电子数的=3/4倍;C与E同主族。
请回答下列问题:
(1) X的化学式为______,D的原子结构示意图为______。
(2)元素的非金属性C______E(填“>”、“<”或“=”),下列各项中,能说明这一结论的事实有______(填序号)。
①氢化物H2E的酸性比H2C强
②氢化物H2C的热稳定性比H2E强
③氢化物H2E的水溶液放置在空气中会变浑浊
(3)将由BC和BC2组成的混合气体通入下图所示装置中,用来验证浓硝酸的氧化性比稀硝酸的氧化性强。
已知(ⅰ)浓硝酸能将气体BC氧化成BC2,而稀硝酸不能氧化BC。
(ⅱ) NaOH溶液与BC2反应的化学方程式为:
2NaOH+2BC2==NaBC2+NaBC+H2O
NaOH溶液与BC气体不反应
a. 装置①、②、③中盛放的药品依次是______、______、______。
b. 通入混合气体之前,应先通入一段时间某另外一种气体,试推测先通入的该气体可以是______(填一种气体的化学式)。
c. 能够说明实验已成功的现象是___________________________。
某温度下,水的离子积Kw=l×10-13。有酸溶液A,pH=a;碱溶液B,pH=b。为测定A、B混合后溶液导电性的变化以及探究A、B的相关性质,某同学设计了如图所示的实验装置。
(1)实验时,烧杯中应盛(选A或B)溶液。
(2)若A为一元强酸,B为一元强碱,且a+b=13。该同学在烧杯中先加入其中一种溶液,闭合开关K,测得烧杯中灯泡的亮度为10(假设亮度由暗到亮表示为1、2、3、…10、11、12、… 20)。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当从滴定管滴入烧杯中的溶液体积和烧杯中盛有的溶液体积相等时,停止滴加溶液并闭合开关K,此时灯泡G的亮度约为,原因是。烧杯中得到的溶液pH=。
(3)若A为强酸,B为强碱,且a+b=13。断开开关K,将滴定管中的溶液逐滴加入到烧杯中。当测得烧杯中溶液pH和“(2)”中最后得到的溶液pH相同时,停止滴加溶液。此时烧杯中的溶液中阳离子浓度大于阴离子浓度,原因可能是。
(4)若A的化学式为HR,B的化学式为MOH,且a+b=13,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为________。
此时烧杯中的混合溶液中,微粒浓度大小关系一定正确的是______(填序号)。
①c(MOH)>c(M+)>C(R-)>c(H+)>c(OH-)
②c(HR)>c(M+)>c(R-)>c(OH-)>c(H+)
③c(R-)>c(M+)>c(H+)>c(OH-)
④c(M+)>c(R-)>c(OH-)>c(H+)
⑤c(M+)+ c(H+)=c(R-)+c(OH-)
⑥c(MOH)=c(H+)-c(OH-)
Ⅰ、现有下列仪器或用品:①铁架台(含铁圈、各种铁夹);②锥形瓶;③滴定管(酸式与碱式);④烧杯(若干个);⑤玻璃棒;⑥天平(含砝码);⑦滤纸;⑧量筒;⑨三角漏斗。有下列药品:①NaOH固体;②0.1000mol/L的标准NaOH溶液;③未知浓度的盐酸;④Na2CO3溶液。试回答以下问题。
(1)做酸碱中和滴定时,还缺少的试剂是(全对得分,下同)
(2)配制250mL0.1000mol/LNaOH溶液时,还缺少的仪器是。
(3)过滤时,应选用上述仪器中的(填编号)
Ⅱ、为测定某H2C2O4溶液的浓度,取25.00mL该溶液于锥形瓶中,加入适量稀H2SO4后,用浓度为c mol/L KMnO4标准溶液滴定。滴定原理为:
2KMnO4+5H2C2O4+3H2SO4=K2SO4+10CO2↑+2MnSO4+8H2O
(1)滴定时,KMnO4溶液应装在(填“酸式滴定管”或“碱式滴定管”)中,达到滴定终点的现象为。
(2)若滴定时,没用标准液洗涤滴定管,会使得草酸溶液的物质的量浓度_(填“偏高”“偏低”“无影响”)
(3)若滴定时,反应前后的两次读数分别为a和b,则实验测得所配草酸溶液的物质的量浓度为
mol/L。
(4)在该溶液与KOH溶液反应所得的0.1 mol/L KHC2O4溶液中,c(C2O42-)>c(H2C2O4),下列关系正确的是。
| A.c(K+)+c(H+)=c(HC2O4-)+c(OH-)+c(C2O42-) |
| B.c (HC2O4-)+ c (C2O42-)+ c(H2C2O4)=0.1mol/L |
| C.c(H+)<c(OH-) |
| D.c(K+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-) |
(1)物质的量浓度均为0.1 mol/L的下列溶液:①NH4Cl、②Na2CO3、③NaHCO3、④NaHSO4、⑤CH3COOH、⑥NaOH,pH由大到小的顺为: (填数字代号)
(2)氢气燃烧热值高。实验测得,在常温常压下,1 g H2完全燃烧生成液态水,放出142.9 kJ热量。则H2燃烧的热化学方程式为__________________________________。
(3)常温下,0.1 mol/L的NaHCO3溶液的pH大于8,则溶液中C(H2CO3)____C( CO32-) (填>、=或<),原因_____________
(用离子方程式和必要的文字说明)
(4)常温下,pH=a某强酸溶液V1 L,pH=b某强碱溶液V2 L,已知a+b=12,两溶液混合后pH=7,求V1 和V2的关系
(5)25℃下,某Na2SO4溶液中c(SO42-)=5×10-4 mol·L-1,取该溶液1 mL,加水稀释至10 mL,则稀释后溶液中c (Na+)∶c (OH-)=________
(6)常温下,已知Ksp(Mg(OH)2)=1.8×10-11,则Mg(OH)2在pH=12.00的NaOH溶液中的Mg2+浓度
为mol·L-1
(10分)某兴趣小组的同学用下图所示装置研究有关电化学的问题(甲、乙、丙三池中的溶质足量),当闭合该装置的电键K时,观察到电流表的指针发生了偏转。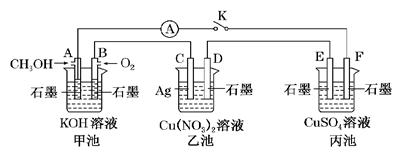
请回答下列问题:
(1)甲池为_____(填“原电池”、“电解池”或“电镀池”),A电极的电极反应式为。
(2)丙池中F电极为________(填“正极”、“负极”、“阴极”或“阳极”),该池的总反应方程式为______。
(3)当乙池中C极质量减轻10.8 g时,甲池中B电极理论上消耗O2的体积为________mL(标准状况)。
(4)一段时间后,断开电键K。下列物质能使乙池恢复到反应前浓度的是________(填字母)。
| A.Cu | B.CuO | C.Cu(OH)2 | D.Cu2(OH)2CO3 |
(1)若把H2O2看成是二元弱酸,请写出在水中的电离方程式:
_________________________________
(2)碘也可用作心脏起搏器电源—锂碘电池的材料。该电池反应为2Li(s)+I2(s)==="2LiI(s)" ΔH
已知:①4Li(s)+O2(g)===2Li2O(s) ΔH1②4LiI(s)+O2(g)===2I2(s)+2Li2O(s) ΔH2
则电池反应的ΔH=__________
(3)某温度时,在2 L容器中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示。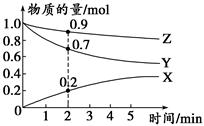
由此分析,该反应的化学方程式为________________________;
从反应开始至2 min时,Z的反应速率为____________。
(4)在某温度时,测得0.01 mol·L-1的NaOH溶液的pH=10。在此温度下,将1mL 0.1mol/L KOH溶液加水稀释至1L,则溶液的pH为,若加水稀释至1000L,则溶液的pH为。