1673年,英国科学家波义耳将金属放在密闭容器里煅烧,煅烧后他立即打开容器盖进行称量,发现反应后的固体质量增加了。波义耳的实验结果是否违反质量守恒定律?请判断并简析原因。
下图是转化汽车尾气中有害气体的微观示意图。
(1)反应前的图示中含有种分子;
(2)图中所示的化学方程式;
(3)从图中你还能获取的信息是。
我国的酒文化源远流长,民间常有“以酒会客”的习俗,其国酒 “茅台”更是中外闻名。请你回答下列问题:
(1) “茅台”开瓶十里香,这表明分子具有的性质。
(2)“茅台”的主要成分之一是乙醇,其化学式为。
(3)“开车不喝酒,喝酒不开车”。今年国家对“酒驾”给予了更严厉的处罚。交警用“酒精检测仪”很快可以检测出司机的饮酒程度,其化学反应原理是:
C2H5OH+4X+6H2SO4 = 2Cr2(SO4)3 + 2CO2↑+9H2O
化学方程式中X的化学式。
请在H、O、N、Na这四种元素中选择恰当的元素,组成一种符合要求的物质,并将其化学式填写在相应的位置上。
(1)由三种元素组成的酸:。
(2)由三种元素组成的碱:。
(3)由三种元素组成的盐:。
(4)空气污染物中会造成酸雨的氧化物:。
在氦气、硝酸铵、甲烷、活性炭四种物质中,属于最简单有机物的是_①__,可用来填充飞艇的是__②__,可用作化肥的是__③,可用作冰箱除味剂的是__④__(填化学式)。
某实验小组研究盐酸、氢氧化钙两种物质的化学性质,做了如下图所示8个实验。
已知:Na2CO3+CaCl2=CaCO3↓+2NaCl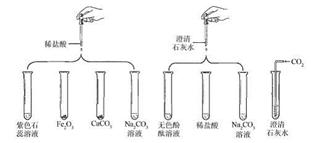
(1)若实验后某试管中为黄色溶液,则该试管中发生反应的化学方程式为:
(2)若实验后某试管中为红色溶液,则向其中加入足量的________,溶液变为无色。由此推断,该试管中最初盛有的物质是___________。
(3)若实验后某试管的底部有白色固体,且过滤后向滤液中滴加稀盐酸,一段时间后有气泡出现,则该试管中最初发生反应的化学方程为。
(4) 实验后某试管中得到无色溶液A,向其中加入足量的Na2CO3溶液,无明显现象。由此推断,该试管中最初发生反应的化学方程式为;无色溶液A中的溶质可能是。
(5)在实验中发生中和反应的化学方程式为。
(6)若将二氧化碳通入澄清石灰水中,生成5g 白色沉淀,过滤后用多少克10%的稀盐酸能将白色沉淀恰好溶解。