在一定条件下,萘可以和硝酸、硫酸和混合酸发生硝化反应,生成二硝基物,它是1,5-二硝基萘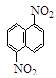 和1,8—二硝基萘
和1,8—二硝基萘 的混合物。后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一可以将这两种异构体分离。将上述硝化产物加入适量的98.3%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8—二硝基萘,应采用方法是
的混合物。后者可溶于质量分数大于98%的硫酸,而前者不能。利用这一可以将这两种异构体分离。将上述硝化产物加入适量的98.3%硫酸,充分搅拌,用耐酸漏斗过滤,欲从滤液中得到固体1,8—二硝基萘,应采用方法是
| A.对所得的滤液蒸发、浓缩、冷却、结晶 | B.向滤液中缓缓加入水后过滤 |
| C.向滤液中加入Na2CO3溶液后过滤 | D.将滤液缓缓加入水中后过滤 |
能影响水的电离平衡,并使溶液中的c(H+)>c(OH-)的操作是
| A.向水中投入一小块金属钠 |
| B.将水加热煮沸 |
| C.向水中通入二氧化碳气体 |
| D.向水中加食盐晶体 |
如果25 ℃时,Kw=1.0×10-14,某温度下Kw=1.0×10-12。这说明
| A.某温度下的电离常数较大 |
| B.前者的c(H+)较后者大 |
| C.水的电离过程是一个放热过程 |
| D.Kw和K电离无直接关系 |
在醋酸中存在电离平衡:CH3COOH CH3COO-+H+,要使电离平衡右移且c(H+)增大,应采取的措施是
CH3COO-+H+,要使电离平衡右移且c(H+)增大,应采取的措施是
| A.加入NaOH(s) | B.加入盐酸 |
| C.加蒸馏水 | D.升高温度 |
在醋酸溶液中,CH3COOH的电离达到平衡的标志是
| A.溶液显电中性 |
| B.溶液中无醋酸分子 |
| C.氢离子浓度恒定不变 |
| D.溶液中CH3COOH和CH3COO-共存 |
下列叙述中,能证明某物质是弱电解质的是
| A.熔融时不导电 |
| B.水溶液的导电能力很差 |
| C.不是离子化合物,而是极性共价化合物 |
| D.溶液中已电离的离子和未电离的分子共存 |