为检验某卤代烃中的X元素,下列操作:(1)加热煮沸;(2)加入AgNO3溶液;(3)取少量该卤代烃;(4)加入足量稀硝酸酸化;(5)加入NaOH溶液;(6)冷却。正确的操作顺序是
| A.(3) (1) (5) (6) (2) (4) | B.(3) (5) (1) (6) (4) (2) |
| C.(3) (2) (1) (6) (4) (5) | D.(3) (5) (1) (6) (2) (4) |
下列说法正确的是( )
| A.根据醋酸溶液中分子和离子共存,即可证明溶液达到了电离平衡状态 |
| B.c(CH3COO﹣)=c(H+),则醋酸溶液达到电离平衡状态 |
| C.当NH3•H2O达到电离平衡时,溶液中NH3•H2O和OH﹣的浓度肯定相等 |
| D.磷酸是分步电离的,电离程度依次减弱 |
下列说法正确的是
| A.分子式C7H16的烃,分子中有4个甲基的同分异构体有4种(不考虑立体异构) |
B. 的名称为:2,2,4﹣三甲基﹣4﹣戊烯 的名称为:2,2,4﹣三甲基﹣4﹣戊烯 |
C.化合物 是苯的同系物 是苯的同系物 |
| D.植物油的主要成分是不饱和高级脂肪酸 |
下列说法不正确的是
| A.可通过酸性高锰酸钾溶液来区别乙烷和乙炔 |
| B.乙烯是石油裂解后的产物 |
| C.石油的分馏、煤的干馏是物理变化,石油的裂解和裂化是化学变化 |
| D.棉花、蛋白质、淀粉都是高分子化合物,都能发生水解反应 |
下列有关说法正确的是( )
| A.根据是否有丁达尔效应,可将分散系分为溶液、胶体和浊液 |
| B.含有最高价元素的化合物一定具有强氧化性 |
| C.NH3、SO2、SO3都是非电解质,氯化钠溶液、硫酸铜溶液都是电解质 |
| D.Na2CO3、NaHCO3、SiO2的俗称分别为纯碱、小苏打、硅石 |
在标准状况下,将a L NH3完全溶于水得到V mL氨水,溶液的密度为ρ g•cm-3,溶质的质量分数为ω,溶质的物质的量浓度为Cmol/L.下列叙述中正确的是( )
A.ω=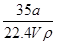 ×100% ×100% |
B.c= |
C.可用装置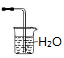 吸收氨气 吸收氨气 |
| D.上述溶液中再加入VmL水 ,所得溶液的质量分数大于0.5ω |