将0.1mol两种气态烃(其中一种为炔烃)组成的混合气体完全燃烧后得3.36L(标况)CO2和3.6gH2O。则这两种烃的物质的量之比说法正确的是 ( )
| A.1:1 | B.1:2 | C.1:3 | D.无法计算 |
有机物的天然提取和人工合成往往得到的是混合物,假设给你一种这样的有机混合物让你研究,一般要采取的几个步骤是
| A.分离、提纯→确定化学式→确定实验式→确定结构式 |
| B.分离、提纯→确定实验式→确定化学式→确定结构式 |
| C.分离、提纯→确定结构式→确定实验式→确定化学式 |
| D.确定化学式→确定实验式→确定结构式→分离、提纯 |
根据下列反应步骤,由2-丙醇转化为1,2—丙二醇(HOCH2—CHOH—CH3)的正确的反应类型的顺序是
| A.消去―加成―水解 | B.取代―消去―加成 |
| C.消去―取代―加成 | D.水解―取代―取代 |
巴豆酸的结构简式为CH3-CH=CH-COOH,现有
①溴水②氢氧化钠溶液③2-丙醇④酸化的高锰酸钾溶液。
试根据其结构特点判断在一定条件下能与巴豆酸反应的物质组合是
| A.①④ | B.①③④ |
C.②③ | D.①②③④ |
芳香烃C8H10有四种同分异构体,其中苯环上的一氯取代物不存在同分异构体,则该种物质的结构是
A.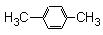 |
B.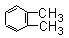 |
C.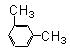 |
D.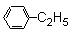 |
下列化合物分子中,在核磁共振氢谱图中能给出二种信号的是
| A.CH3CH3 | B.CH3COOCH3 | C.CH3COCH2CH3 | D.CH3OCH3 |