化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
(1)从物质的分类角度看,不恰当的一种物质是 。
(2)“三酸”与“两碱”之间均可反应,酸过量时若用化学方程式表示有六个,若用离子方程式表示却只有两个,请写出这两个离子方程式 ; 。
(3)“三酸”常用于溶解金属和金属氧化物。下列块状金属在常温时能全部溶于足量浓硝酸的是 。
| A.Ag | B.Cu | C.Al | D.Fe |
(4)烧碱、纯碱均可吸收CO2,当含0.2 mol NaOH的溶液吸收一定量CO2后,将溶液低温蒸干得到固体的组成可能有四种情况,分别是:
① ;②Na2CO3;③ ;④NaHCO3
将得到的固体重新溶解于水,在溶液中加过量的盐酸,使其充分反应后,再将溶液蒸干,得到固体的质量是 g。
(14分)在某温度下、容积均为2L的三个密闭容器中,按不同方式投入反应物,保持恒温恒容,使之发生反应:2 H2(g)+CO(g) CH3OH(g);
CH3OH(g);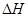 =-a KJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下:
=-a KJ·mol-1(a>0)。初始投料与各容器达到平衡时的有关数据如下: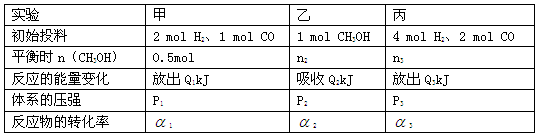
(1)该温度下此反应反应物的总键能和(填“大于”“等于”或“小于”)生成物的总键能和。
(2)在该温度下,假设甲容器从反应开始到平衡所需时间为4 min,则H2的平均反应速率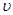 ( H2)为。
( H2)为。
(3)下列选项能说明甲容器中的反应已经达到平衡状态的有 (填序号)。
A.容器内H2、CO、CH3OH的物质的量之比为2:1:1
B.容器内气体的密度保持恒定
C.容器内H2气体的体积分数保持恒定
D.2V正(H2)=V逆(CO)
(4)丙容器中,平衡后将容器的容积压缩到原来的l/2,其他条件不变,对平衡体系产生的影响是
(填字母序号)。
A.c(H2)减少
B.正反应速率加快,逆反应速率减慢
C.CH3OH 的物质的量增加
D.重新平衡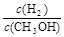 减小
减小
E.平衡常数K增大
(5)三个容器中的反应分别达平衡时各组数据关系正确的是(填序号)。
A.Q1+Q2=aB.α3<α1
C.P3<2P1=2P2D.n2<n3<1.0mol
(6)已知:①3CO(g) +3H2(g) CH3OCH3(g) +CO2(g)△H=—247kJ·mol-l
CH3OCH3(g) +CO2(g)△H=—247kJ·mol-l
②2CH3OH(g) CH3OCH3(g)+H2O(g)△H= -24 kJ·mol-l
CH3OCH3(g)+H2O(g)△H= -24 kJ·mol-l
③CO(g)+H2O(g) CO2(g)+H2(g)△H= -41 kJ·mol-l
CO2(g)+H2(g)△H= -41 kJ·mol-l
2 H2(g)+CO(g) CH3OH(g);
CH3OH(g);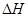 =-a KJ·mol-1,则a=
=-a KJ·mol-1,则a=
以铬铁矿(主要成分是FeO·Cr2O3,含少量MgCO3、Al2O3、SiO2等)为原料制取铬酸钠(Na2CrO4)晶体的工艺流程如下: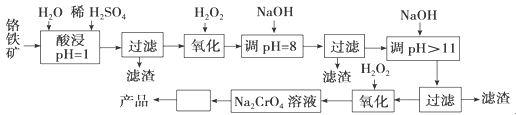
已知:①+3价Cr在酸性溶液中性质稳定,当pH>9时以CrO2-形式存在且易氧化;
②常温下,部分阳离子以氢氧化物形式沉淀时溶液的pH如下: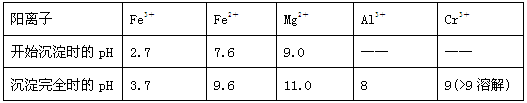
(1)流程中两次使用了H2O2,分别写出反应的离子方程式:
__________________________________、____________________________________。
(2)加入NaOH调节溶液的pH=8时,被除去的离子是________;调节溶液的pH>11时,被除去的离子是________。
(3)“调pH=8”和“调pH>11”中间的“过滤”步骤能否省略,为什么?请用必要的文字和离子方程式解释:_______________________________________________________。
(4)流程图中“□”内的操作是___________________、______________________、。
A、B、C、D、E都是周期表中前四周期的元素。已知A原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大。B的基态原子占据两种形状的原子轨道,且两种形状轨道中的电子总数相同,B位于元素周期表的S区。C元素原子的外围电子层排布式为nsn—1npn—1。D原子M能层为全充满状态,且最外层无成对电子,E的化合物种类最多。请回答下列问题:
(1)写出D基态原子的电子排布式;
(2)A的常见氢化物AH3的VSEPR模型为
(3)已知A和C形成的化合物X中每个原子的最外层均为8电子稳定结构,则X的化学式为 ,X是一种超硬物质,耐磨损、抗腐蚀能力强,
推测X的晶体类型为。
(4)E的最高价氧化物的结构式为中心原子的杂化方式为。
(5)B的单质与A的最高价含氧酸的稀溶液反应,能将A还原至最低价态,写出该反应的化学方程式 。
(6)TiO2的天然晶体中,最稳定的一种晶体结构如下图,黑球表示原子。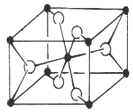
(7)二茂铁(C5H5)2Fe是Fe2+与环戊二烯基离子结合形成的小分子化合物,该化合物中Fe2+与环戊二烯基离子之间以(填“离子键”、“金属键”、“配位键”、“氢键”、“范德华力”)相结合。
(1)已知C(石墨,s)= C(金刚石,s);△H>0,则稳定性:金刚石石墨(填>或<)
(2)已知2C(s)+2O2(g)=2CO2(g)△H1;2C(s)+O2(g)=2CO(g)△H2。则△H1△H2(填>或<)
(3)“嫦娥五号”预计在海南文昌发射中心发射,火箭的第一、二级发动机中,所用的燃料为偏二甲肼和四氧化二氮,偏二甲肼可用肼来制备. 用肼(N2H4)为燃料,四氧化二氮做氧化剂,两者反应生成氮气和气态水.
已知:N2(g)+2O2(g)=N2O4(g)△H="+10.7kJ·" mol-1
N2H4(g)+O2(g)=N2(g)+2H2O(g)△H="-543" kJ· mol-1
写出气态肼和N2O4反应的热化学方程式为。
(4)25℃,101kPa时,14gCO在足量的O2中充分燃烧,放出141.3 kJ的热,则CO的燃烧热为△H=。
(5)0.50L 2.00mol/L H2SO4溶液与2.10L 1.00mol/L KOH溶液完全反应,放出114.6kJ的热量,该反应的中和热为△H=
(6)已知拆开1molH-H键,1molN-H键,1molN≡N键分别需要的能量是436kJ、391 kJ、
946 kJ,则N2与H2反应生成NH3的热化学方程式是。
【物质结构与性质】(15分)钙的化合物在工农业生产和生活中有广泛的应用.
(1)已知CaC2与水反应生成乙炔.请回答下列问题:
①将乙炔通入[Cu(NH3)2]Cl溶液中生成Cu2C2红棕色沉淀,Cu+基态核外电子排布式为___________________.
②CaC2中C22-与O22+互为等电子体,1molO22+中含有的π键数目为_________.
③乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N).丙烯腈分子中碳原子轨道杂化类型是_______________,构成丙烯腈元素中第一电离能最大的是__________.
(2)抗坏血酸钙的组成为Ca(C6H7O6)2•4H2O,其结构示意图如图1: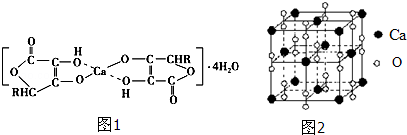
该物质中存在的化学键类型包括____________(填字母).
| A.金属键 | B.离子键 | C.非极性共价键 | D.配位键 |
(3)钙在氧气中燃烧时得到一种钙的氧化物晶体,其结构如图2所示:由此可判断该钙的氧化物的化学式为____________.已知阿伏加德罗常数为NA,该晶体的密度为ρg·cm3,则晶胞中两Ca2+间的最近距离为______________cm.(用含NA、ρ的代数式表示)