如图中a、b、c、d、e、f为元素周期表中前4周期的一部分元素,下列有关叙述正确的是
| |
|
|
|
a |
| |
|
b |
c |
|
| d |
e |
|
|
|
| |
|
|
f |
|
| A.b、c、e三种元素的原子半径大小关系:e>c>b |
| B.六种元素分别形成的单质晶体中,d的熔、沸点最高 |
| C.c的氢化物沸点比f的氢化物沸点低 |
| D.b元素除0价外,只有一种化合价 |
下列关于糖类的说法中,错误的是()
| A.葡萄糖和果糖化学式(C6H12O6)相同,它们是同分异构体 |
| B.麦芽糖和蔗糖化学式(C12H22O11)相同,它们是同分异构体 |
| C.淀粉和纤维素化学式[(C6H10O5)n]相同,它们是同分异构体 |
| D.多糖可以水解成单糖,单糖不能再水解成更小的糖分子 |
下列关于有机化合物的说法中,正确的是()
| A.含有碳元素的化合物都是有机化合物 |
| B.易溶于汽油、苯等有机溶剂的物质一定是有机化合物 |
| C.能够燃烧的化合物是有机化合物 |
| D.有机化合物的同分异构现象,是有机化合物种类繁多的重要原因之一 |
下列离子方程式书写正确的是()
| A.烧碱溶液与小苏打溶液反应:OH-+HCO3- |
| B.铝粉与烧碱溶液反应:2Al+2OH-+6H2O |
| C.向氯化亚铁溶液中滴加氯水:2Fe2++Cl2 |
| D.氯气通入氢氧化钠溶液中:Cl2+ OH- |
对于化学键的理解,下列叙述正确的是()
| A.共价化合物中一定只含有共价键 |
| B.离子化合物中一定只含有离子键 |
| C.在任何物质中,都存在着化学键 |
| D.物质的化学键被破坏,则一定发生化学变化 |
下列反应中, 属于取代反应的是
| A.C2H5OH C2H4↑+ H2O |
| B.2CH3CHO + O22CH3COOH |
| C.CH3—CH=CH2 + Br2 ─→CH3—CHBr-CH2Br |
D.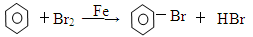 |