下列离子方程式书写正确的是
A 氯化铝溶液中加入过量的氨水:Al3+ + 4NH3 H2O = AlO2- + 4NH4+ + 2H2O
B 过量CO2通入NaAlO2溶液中:CO2 + A lO2- + 2H2O = HCO3- + Al(OH)3↓
lO2- + 2H2O = HCO3- + Al(OH)3↓
C 碳酸钙溶于醋酸:CaCO3 + 2H+ = Ca2+ + CO2 ↑+ H2O
D 氯化亚铁溶液中通入氯气:Fe2+ + Cl2 = Fe3+ + 2Cl-
某有机物分子由 、-CH=CH-两种结构单元组成,且它们自身不能相连,该烃分子中C、H两原子物质的量之比是
、-CH=CH-两种结构单元组成,且它们自身不能相连,该烃分子中C、H两原子物质的量之比是
A 2︰1 B 8︰5 C 3︰2 D 22︰19
往溴的苯溶液中加入少量铁屑能迅速反应,其过程如下:3Br2+2Fe=2FeBr3;Br2+FeBr3=FeBr4-+Br+(不稳定); +Br+→[
+Br+→[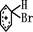 ];[
];[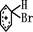 ]+FeBr4-→
]+FeBr4-→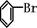 +HBr+FeBr3;由上反应可知:
+HBr+FeBr3;由上反应可知: +Br2→
+Br2→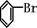 +HBr中的催化剂为
+HBr中的催化剂为
A FeB FeBr3C Br+D FeBr4-
实验室里用苯与溴反应制取溴苯,反应后将所得液体倒入水中,分层后水底褐色的液体是
A溴苯 B溶有溴的苯 C溶有溴的溴苯 D氢溴酸
下列变化发生的既不是取代反应,又不是加成反应的是
A乙烯→乙醇 B甲苯→TNT C丁烷→乙烯 D苯→硝基苯
以苯为原料,不能一步制得的是
A环己烷 B苯磺酸钠 C溴苯 D硝基苯