下列有关结论正确的是
| A.T℃时,Ba(OH)2溶液中c(H+)·c(OH-)=10-12,向pH=8的该溶液中加入等体积pH=4的盐酸,则混合溶液的pH=7 |
| B.pH相等的硫酸.盐酸.醋酸,都稀释1000倍,稀释后,pH最大的是醋酸 |
| C.0.2mol/L的HA溶液与0.1mol/L的NaOH溶液等体积混合,混合液在常温时pH一定小于7 |
| D.在0.1mol/L的硫酸氢铵溶液中各离子浓度关系是:c(H+)>c(SO42-)> c(NH4+)> c(OH-) |
食品保鲜膜按材质分为聚乙烯(PE)、聚氯乙烯(PVC)等种类。PE保鲜膜可直接接触食品,PVC保鲜膜则不能直接接触食品,它对人体有潜在危害。下列有关叙述不正确的是( )
A.PE、PVC都属于链状高分子化合物,受热易熔化
B.PE、PVC的单体都是不饱和烃,能使溴水褪色
C.焚烧PVC保鲜膜会放出有毒气体如HCl
D.废弃的PE和PVC均可回收利用以减少白色污染
2012年6月29日“神舟九号”返回舱安全着陆,着陆时巨大的回收伞格外引人注目,“神舟九号”回收伞(如图)不同于普通的航空伞,它是采用强力高、重量轻、缓冲性好的特制涤纶材料制成的,伞撑开的面积有1200平方米。下列关于涤纶材料的说法中不正确的是( )
| A.涤纶属于高分子材料 |
| B.“神舟九号”回收伞用的这种涤纶材料耐高温 |
| C.涤纶属于合成橡胶 |
| D.合成涤纶的反应属于聚合反应 |
导电聚合物塑料能够像金属一样表现导电性能。以聚乙炔为例,要使其能够导电,必须用I2或Na等做掺杂处理,实验过程如下:[CH]n+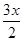 I2―→[CH]nx++xI3—。聚乙炔的碳链结构片段可表示为—C=C—C=C—C=C—。下列叙述正确的是( )
I2―→[CH]nx++xI3—。聚乙炔的碳链结构片段可表示为—C=C—C=C—C=C—。下列叙述正确的是( )
| A.这种可导电的塑料是一种纯净物,有固定的熔、沸点 |
| B.掺杂后的聚乙炔之所以可导电,是因为它具有类似盐的结构 |
| C.聚乙炔和碘的掺杂反应中,聚乙炔被还原 |
| D.聚乙炔经掺杂反应后,分子内碳链结构未发生变化 |
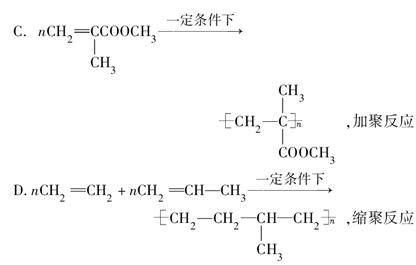
下列合成高分子材料的反应式和反应类型均正确的是( )
萤火虫发光原理如下:
关于荧光素及氧化荧光素的叙述,正确的是( )
| A.互为同系物 |
| B.均可发生硝化反应 |
| C.均可与碳酸氢钠反应 |
| D.均最多有7个碳原子共平面 |